题目内容
8.下列说法正确的是( )| A. | HCl、NaCl溶于水,破坏的化学键类型相同 | |
| B. | 某物质中含有离子键,则该物质在任何条件下均可导电 | |
| C. | 干冰是分子晶体,其气化过程中只需克服分子间作用力 | |
| D. | 常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构 |
分析 A.HCl溶于水破坏的是共价键,NaCl溶于水破坏的是离子键;
B.含有离子键的化合物在固态时不导电;
C.干冰分子之间只存在分子间作用力;
D.氢气中H原子最外层只含有2个电子.
解答 解:A.HCl溶于水破坏的是共价键,NaCl溶于水破坏的是离子键,化学键的种类不同,故A错误;
B.含有离子键的化合物在固态时不导电,因为固体时不存在自由移动的离子,故B错误;
C.干冰分子之间只存在分子间作用力,干冰的气化是物质,则气化过程中只需克服分子间作用力,故C正确;
D.氢气中H原子最外层只含有2个电子,不具有8电子稳定结构,故D错误.
故选C.
点评 本题考查元了物质的导电性、化学键、分子间作用力、8电子稳定结构等,难度不大,侧重对基础知识的巩固,注意理解晶体中微粒之间的作用力.

练习册系列答案
相关题目
19.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 将稀硫酸和Na2S反应生成的气体通入AgNO3与AgCl组成的浊液中 | Ksp(AgCl)>Ksp(Ag2S) |
| B | 室温下,向浓度均为0.1 mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| D | 室温下,用pH试纸测得0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
16. 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(3)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$E.$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCE.
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则相同条件下HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱..
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(3)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$E.$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCE.
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则相同条件下HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱..
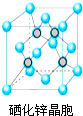
3.据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图2.已知锌的熔点420℃、沸点906℃.则下列说法错误的是( )

| A. | “泥封”的目的是为了防止得到的锌被氧化 | |
| B. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 | |
| C. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| D. | 升炼倭铅过程包含分解反应和氧化还原反应 |
17.在pH=1溶液中能大量共存的是( )
| A. | Na+、SO42-、Ba2+、Cl- | B. | Na+、K+、CH3COO-、NO3- | ||
| C. | H+、Cu2+、OH-、CO32- | D. | K+、Na+、Cl-、NO3- |
18.关于同温、同压下等体积的CO2和CO的叙述,其中正确的是( )
①质量相等;②密度相等;③所含分子个数相等;④所含碳原子个数相等.
①质量相等;②密度相等;③所含分子个数相等;④所含碳原子个数相等.
| A. | ①②③④ | B. | ②③④ | C. | 只有③④ | D. | 只有④ |
 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.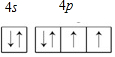 .
.