题目内容
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.2H2(g)+O2(g)=2H2O(l)△H<0
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为
②若电解含有0.04mol CuSO4和0.04mol NaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的pH=
考点:原电池和电解池的工作原理,电解原理
专题:电化学专题
分析:(1)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(2)氢氧燃料碱性电池中,正极上氧气得电子发生还原反应;
(3)①若电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,据此写出电池反应式;
②根据转移电子守恒计算阴极上析出的物质,再根据氧气计算生成的C(H+),从而得出其pH.
(2)氢氧燃料碱性电池中,正极上氧气得电子发生还原反应;
(3)①若电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,据此写出电池反应式;
②根据转移电子守恒计算阴极上析出的物质,再根据氧气计算生成的C(H+),从而得出其pH.
解答:
解:(1)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故B正确;
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故C错误;
故选B;
(2)以KOH溶液为电解质溶液,氢氧燃料碱性电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:O2+4e一+2 H2O=4OH一,故答案为:O2+4e一+2 H2O=4OH一;
(3)①电解硫酸铜溶液时,阳极上生成氧气,阴极上生成铜,同时溶液中生成硫酸,所以电池反应式为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
②电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先生成氯气后生成氧气,阴极上先生成铜,后生成氢气,阳极上氯气完全析出时,氯气的体积=
×22.4L/mol=448mL<672mL,所以阳极上还有224mL氧气,阳极上转移电子的物质的量=0.04mol×1+
=0.08mol,阴极上铜完全析出时,需要电子的物质的量=0.04mol×2=0.08mol,所以阴极上不析出氢气,生成224mL氧气时,阳极附近同时生成C(H+)=
=0.1mol/L,所以溶液的pH=1,
故答案为:1.
B.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故B正确;
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故C错误;
故选B;
(2)以KOH溶液为电解质溶液,氢氧燃料碱性电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:O2+4e一+2 H2O=4OH一,故答案为:O2+4e一+2 H2O=4OH一;
(3)①电解硫酸铜溶液时,阳极上生成氧气,阴极上生成铜,同时溶液中生成硫酸,所以电池反应式为:2CuSO4+2H2O
| ||
| ||
②电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先生成氯气后生成氧气,阴极上先生成铜,后生成氢气,阳极上氯气完全析出时,氯气的体积=
| 0.04mol |
| 2 |
| 0.224L |
| 22.4L/mol |
| ||
| 0.4L |
故答案为:1.
点评:本题考查构成原电池的条件、电解池的有关计算等知识点,难点是(3)中溶液pH的计算,只有明确阴阳极上析出的物质才能正确解答,为易错点

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+→BaSO4↓ |
| B、稀硝酸中加入少量碳酸亚铁:FeCO3+2H+→Fe2++CO2↑+H2O |
| C、硫酸氢铵溶液中滴入几滴氢氧化钠溶液:H++OH-═H2O |
| D、饱和碳酸钠溶液中通入二氧化碳气体:2Na++CO32-+CO2+H2O═2NaHCO3↓ |
白云石的化学式是xCaCO3?yMgCO3.可用于制取耐火材料等,优质的白云石粉可作为昂贵的二氧化钛填料的替代品.现称取27.6g白云石,加热到质量不再变化,收集到的CO2为6.72L(已换算成标准状况).下列有关说法正确的是( )
| A、白云石的化学式为2CaCO3?MgCO3 |
| B、残留固体的质量为14.4g |
| C、取13.8g该白云石与足量盐酸完全反应,最多收集到标准状况下的CO22.24L |
| D、27.6g白云石与过量盐酸完全反应,可消耗HCl0.3mol |
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 物质 编号 |
物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① | 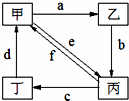 |
Cu | CuO | CuSO4 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | CH3CH2Cl | C2H5OH | CH2=CH2 | CH3CH3 |
| A、①②③④ | B、①②③ |
| C、①③④ | D、②④ |
在指定条件下,下列各组离子可能大量共存的是( )
A、无色澄清透明溶液中:H+、Cu2+、S
| ||||
B、与铝反应放出H2的溶液中:NH4+、K+、N
| ||||
C、滴加酚酞显红色有溶液中:Na+、ClO-、S2-、S
| ||||
D、由水电离的c(OH-)=10-13mol?L-1的溶液中:Na+、Cl-、C
|
根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A、由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同 | |||||||||||
| B、氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |||||||||||
| C、表中②组反应的还原产物是KCl,转移6e- | |||||||||||
D、表中③组反应的离子方程式为2Mn
|
 Ⅰ.尿素是一种氮肥,溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是
Ⅰ.尿素是一种氮肥,溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是