题目内容
20.如图是某些化学键的键能,| 化学键 | H-H | O=O | H-O |
| 键能(KJ/mol) | 436 | 496 | 463 |
| A. | 242 | B. | -242 | C. | 484 | D. | -484 |
分析 依据反应焓变=反应物总键能-生成物总键能就是得到a值;
解答 解:对于反应:2H2(g)+O2(g)=2H2O(g)△H=a KJ/mol,焓变=反应物总键能-生成物总键能,
a KJ/mol=2×436KJ/mol+496KJ/mol-2×2×463KJ/mol,
得到a=-484,
故选D.
点评 本题考查了反应能量变化分析判断,主要是根据键能计算反应焓变的应用,掌握基础是关键,题目较简单.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
10.下列说法不正确的是( )
| A. | 石油分馏可获得汽油、煤油等矿物油,煤焦油干馏可获得苯、甲苯等有机物 | |
| B. | 使用“燃煤固硫”、“汽车尾气催化净化”等可减少空气污染 | |
| C. | 汽油、煤油、大豆油中所含主要成分均为烃类 | |
| D. | 硬脂酸甘油酯在碱性条件下的水解属于皂化反应 |
11.已知反应X+Y=M+N为放热反应,对这个反应的下列说法中正确的是( )
| A. | X的能量一定高于M的能量 | |
| B. | 因为该反应为放热反应,故不需要加热就能进行 | |
| C. | X和Y的总能量一定低于M和N的总能量 | |
| D. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
8.氢能是一种理想的“绿色能源”,以下有关氢能开发的方式中最理想的是( )
| A. | 大量建设水电站,用电力分解制取氢气 | |
| B. | 利用化石燃料燃烧放热,高温分解水产生氢气 | |
| C. | 在催化剂作用下,利用太阳能分解水 | |
| D. | 利用铁等金属与酸反应产生氢气 |
15.下列各图中,表示正反应是放热反应的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
9.某研究小组采用矿浆电解法从复杂锑铅矿(主要成分为Sb2S3、PbS、FeS)提取金属锑,实现了锑、铅的一步分离.其工艺流程图如下:
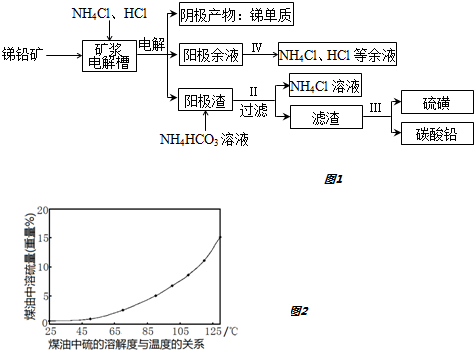
已知:①Sb3++6Cl??SbCl63?
②
(1)加入NH4Cl可以提高电解时SbCl3在阳极区的溶解度,理由是提高氯离子浓度,使Sb3++6Cl-?SbCl63-正向移动.
(2)Sb2S3在阳极区因硫元素被氧化而溶解,写出电极反应式Sb2S3+12Cl--6e-=3S+2SbCl63-或Sb2S3-6e-=3S+2Sb3+; Sb2S3也可以被电解生成的Fe3+溶解,反应的离子方程式为6Fe3++Sb2S3+12Cl-=6Fe2++3S+2SbCl63-或6Fe3++Sb2S3=3S+2Sb3++6Fe2+.
(3)阳极渣中含铅化合物的化学式为PbCl2.
(4)步骤Ⅱ反应选择在40~50℃进行,温度不宜过高的原因是防止NH4HCO3分解.
(5)单质硫在煤油中的溶解度曲线如图2.利用煤油为溶剂将滤渣中的碳酸铅和单质硫分离,步骤Ⅲ的操作方法是:用热煤油溶解,趁热过滤;将滤液冷却,过滤.
(6)步骤Ⅳ,先加入NaClO3试剂将Fe2+转化为Fe2O3•nH2O除去,则氧化剂和还原剂的物质的量之比为1:6.

已知:①Sb3++6Cl??SbCl63?
②
| 物质 | Sb2S3 | PbS | FeS | PbCl2 | PbCO3 |
| Ksp | 2×10?93 | 1×10?28 | 6×10?18 | 1.6×10?5 | 7.4×10?14 |
(2)Sb2S3在阳极区因硫元素被氧化而溶解,写出电极反应式Sb2S3+12Cl--6e-=3S+2SbCl63-或Sb2S3-6e-=3S+2Sb3+; Sb2S3也可以被电解生成的Fe3+溶解,反应的离子方程式为6Fe3++Sb2S3+12Cl-=6Fe2++3S+2SbCl63-或6Fe3++Sb2S3=3S+2Sb3++6Fe2+.
(3)阳极渣中含铅化合物的化学式为PbCl2.
(4)步骤Ⅱ反应选择在40~50℃进行,温度不宜过高的原因是防止NH4HCO3分解.
(5)单质硫在煤油中的溶解度曲线如图2.利用煤油为溶剂将滤渣中的碳酸铅和单质硫分离,步骤Ⅲ的操作方法是:用热煤油溶解,趁热过滤;将滤液冷却,过滤.
(6)步骤Ⅳ,先加入NaClO3试剂将Fe2+转化为Fe2O3•nH2O除去,则氧化剂和还原剂的物质的量之比为1:6.
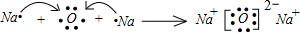 .
. 、
、 ;A、B、E形成的化合物
;A、B、E形成的化合物 ;D、E形成的化合物
;D、E形成的化合物 .
.