题目内容
15.下列各图中,表示正反应是放热反应的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 正反应为放热反应,依据物质能量守恒分析,反应物能量高于生成物能量,据此分析判断;
解答 解:A.反应物能量低于生成物是吸热反应,故A错误;
B.反应物能量高于生成物能量,反应是放热反应,故B正确;
C.反应前后一定伴随能量的变化,反应物能量和生成物能量一定不同,故C错误;
D.化学反应过程中反应物断裂化学键吸收能量变化为原子时能量升高,图象变化不符合能量变化,故D错误;
故选B.
点评 本题考查了化学反应能量变化的分析,注意反应前后能量守恒的应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
3.下列反应属于不属于取代反应的是( )
| A. | 油脂的水解 | |
| B. | 在一定条件下,苯与浓硝酸反应制取硝基苯 | |
| C. | 乙醛与氢气的反应 | |
| D. | 甲烷与氯气在光照条件下反应 |
10.保护环境已成为当前和未来的全球性的重大课题之一,下列因为人类生产对环境破坏而带来的后果是( )
①土地沙漠化 ②酸雨 ③水资源危机 ④南极上抽样空洞 ⑤沙尘暴.
①土地沙漠化 ②酸雨 ③水资源危机 ④南极上抽样空洞 ⑤沙尘暴.
| A. | ①②⑤ | B. | ①②④⑤ | C. | ②⑤ | D. | ①②③④⑤ |
20.如图是某些化学键的键能,
对于反应:2H2(g)+O2(g)=2H2O(g)△H=a KJ/mol,a的值为( )
| 化学键 | H-H | O=O | H-O |
| 键能(KJ/mol) | 436 | 496 | 463 |
| A. | 242 | B. | -242 | C. | 484 | D. | -484 |
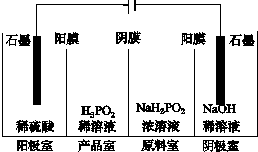 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题: .
.
 2011年9月29日我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:
2011年9月29日我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得: .
.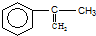 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: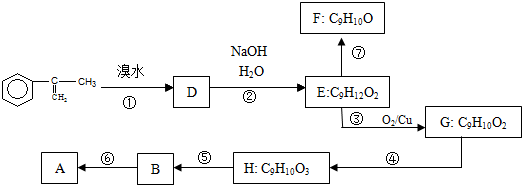
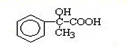
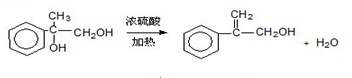 .两分子H之间发生反应生成六元环酯化学方程式是:2
.两分子H之间发生反应生成六元环酯化学方程式是:2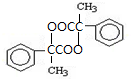 +2H2O.
+2H2O.