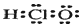题目内容
10.氯化碘(ICl)跟水发生反应:ICl+H2O═HIO+HCl,这个过程可以称为ICl的水解.则(1)ICl与NaOH溶液反应的离子方程式为:ICl+2OH-═IO-+Cl-+H2O;
(2)预计IF5水解的化学反应方程式为:IF5+3H2O═HIO3+5HF.
分析 (1)结合反应ICl+H2O═HIO+HCl及中和反应实质分析;
(2)IF5水解过程中I、F元素的化合价不变,则水解产物为HIO3、HF.
解答 解:(1)因为ICl+H2O=HCl+HIO,所以ICl与NaOH反应生成氯化钠和NaIO,反应的化学方程式为:ICl+2NaOH═NaCl+NaIO+H2O,
故答案为:ICl+2OH-═ IO-+Cl-+H2O;
(2)水解过程中化合价不变,则IF5水解产物为HIO3、HF,反应的化学方程式为:IF5+3H2O═HIO3+5HF,
故答案为:IF5+3H2O═HIO3+5HF.
点评 本题考查了离子方程式、化学方程式的书写方法,题目难度不大,明确发生反应原理为解答关键,注意掌握化学方程式、离子方程式的书写原则,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
16.下列叙述I和II均正确并有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
| B | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
| C | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
| D | Ca(OH)2能制成澄清石灰水 | 可配制2.0mol•L-1的Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
18.下列实验装置正确的是( )
| A. |  实验室制乙烯 | B. |  酯化反应 | ||
| C. |  实验室制取Cl2 | D. |  中和热的测定 |
15.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到NaOH浓溶液中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干,趁热过滤 |
| C | 除去HBr中混有的Br2 | 将混合气通入盛有CCl4的洗气瓶 |
| D | 证明Cu(OH)2的溶度积比Mg(OH)2的小 | 将1mL0.1mol•L-1MgSO4溶液逐滴滴入4mL0.1mol•L-1NaOH溶液,再滴加1mL0.1mol•LCuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |