题目内容
17.反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,(1)请用双线桥标出反应中电子转移的情况.
(2)若有19.2g Cu被氧化,则被还原的HNO3的质量为多少?
分析 (1)氧化还原反应中的,化合价升高值=化合价降低值=转移电子数目;化合价升高的元素被氧化,化合价降低的元素所在的反应物是氧化剂,据此回答;
(2)被还原的硝酸生成NO,根据氮原子守恒n被还原(HNO3)=n(NO),根据关系式3Cu~2NO~2HNO3计算.
解答 解:(1)该氧化还原反应中的,化合价升高的是铜元素,化合价降低的是硝酸中的氮元素,转移电子数为6mol,双线桥法表示电子转移的方向和数目如下所示: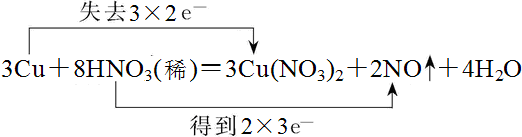 ,
,
故答案为: ;
;
(2)被还原的硝酸生成NO,根据氮原子守恒n被还原(HNO3)=n(NO),则:
3Cu~2NO~2HNO3
3×64 2×63
19.2g m(HNO3)
则m(HNO3)=$\frac{19.2g×2×63}{3×64}$=12.6g
答:被还原的HNO3的质量为12.6g.
点评 本题考查了氧化还原反应电子转移和氧化还原反应的计算,难度中等,本题采取关系式计算,也可以利用电子转移守恒计算.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
12.用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10).试回答:
(1)在25℃时,1L水中约能溶解0.01g碳酸钡,则该温度下碳酸钡的溶度积Ksp=2.58×10-5(2.5×10-9~2.6×10-9均可).
(2)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用酚酞指示剂,理由是酚酞的变色在碱性范围内,此时只有NaOH与HCl反应,BaCO3不与HCl反应(或若用甲基橙等酸性范围内变色的指示剂,则会有部分BaCO3跟盐酸反应,其所消耗的盐酸的量偏大,从而使测定结果偏高);判断到达滴定终点的实验现象是溶液的颜色刚好由浅红变为无色且半分钟内颜色不变化即为滴定终点.
(3)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol•L-1的盐酸标准液进行滴定,相关数据记录如下:
①实验3到达滴定终点时所耗HCl溶液的体积为31.08 mL;依据表中数据,计算出烧碱样品中含NaOH的质量分数为62.08%.(小数点后保留两位数字)
②滴定时的正确操作是左手控制活塞,右手不断摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是BC
A.锥形瓶用蒸馏水洗后未用待测液润洗 B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失 D.滴定前平视读数,滴定结束俯视读数.
(1)在25℃时,1L水中约能溶解0.01g碳酸钡,则该温度下碳酸钡的溶度积Ksp=2.58×10-5(2.5×10-9~2.6×10-9均可).
(2)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用酚酞指示剂,理由是酚酞的变色在碱性范围内,此时只有NaOH与HCl反应,BaCO3不与HCl反应(或若用甲基橙等酸性范围内变色的指示剂,则会有部分BaCO3跟盐酸反应,其所消耗的盐酸的量偏大,从而使测定结果偏高);判断到达滴定终点的实验现象是溶液的颜色刚好由浅红变为无色且半分钟内颜色不变化即为滴定终点.
(3)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol•L-1的盐酸标准液进行滴定,相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
②滴定时的正确操作是左手控制活塞,右手不断摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是BC
A.锥形瓶用蒸馏水洗后未用待测液润洗 B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失 D.滴定前平视读数,滴定结束俯视读数.
7.英国曼彻斯特大学科学家安德烈•海姆和康斯坦丁•诺沃肖洛夫以石墨烯研究获得2010年度诺贝尔物理学奖.石墨烯可看作将石墨的层状结构一层一层的剥开得到的单层碳原子构成的二维蜂窝状晶格结构(如图所示).石墨烯是现在已知的最牢固的一种碳质新材料,有极佳的导电、导热性.下列说法正确的是( )

| A. | 石墨烯是一种有机物 | B. | 石墨烯中碳原子间以共价键结合 | ||
| C. | 石墨烯具有和乙烯相同的性质 | D. | 12g石墨烯中约含6.02×1023个e- |

 的系统命名是:2,6-二甲基辛烷
的系统命名是:2,6-二甲基辛烷 的键线式是
的键线式是

 ,回答下列问题:
,回答下列问题: $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +2H2O.
+2H2O. .
.
 ;C中所含官能团的名称是羧基、溴原子.
;C中所含官能团的名称是羧基、溴原子. .
.