题目内容
15.下列说法正确的是(NA表示阿伏加德罗常数的值)( )| A. | 1molS与铁完全反应转移的电子数为NA | |
| B. | 32g 02和32g O3所含原子数均为2NA | |
| C. | 在常温常压下,22.4LNH3所含原子数为NA | |
| D. | 在标准状况下,2.24L水所含分子数为0.1NA |
分析 A.铁与硫反应生成硫化亚铁;
B.依据元素守恒分析,氧气和臭氧中只含有氧原子,32g氧气和32g臭氧中都含有32g氧原子;
C.标准状况下气体摩尔体积为22.4L/mol;
D.标准状况下水不是气体.
解答 解:A.1molS与铁完全反应生成FeS,反应过程中转移的电子数为2NA ,故A错误;
B.32g氧气和32g臭氧中都含有32g氧原子,含有氧原子的物质的量为2mol,所含原子数均为2NA,故B正确;
C.在常温常压下,22.4LNH3物质的量不是1mol,所含原子数不是NA,故C错误;
D.标准状况下,水不是气体,2.24L水物质的量不是0.1mol,故D错误.
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
5.下列叙述错误的是( )
| A. | 用食醋可以洗水垢{主要成分为CaCO3和Mg(OH)2)} | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氧化钠溶液用带橡胶塞的细口试剂瓶贮存 | |
| D. | 氯水保存在白色细口试剂瓶中 |
6.煤是“工业的粮食”,石油是“工业的血液”.有关煤和石油加工的说法正确的是( )
| A. | 煤的干馏产物主要是各类有机物 | |
| B. | 石油的裂解、分馏和煤的干馏都属于化学变化 | |
| C. | 石油的裂化,说明长链烃在高温条件下可以分解为短链烃 | |
| D. | 煤焦油经过分馏可得到苯、甲苯等,说明煤中含有苯和甲苯 |
3.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案( )
方法Ⅰ:铜铝混合物$→_{充分反应}^{足量溶液A}$测定生成气体的体积
方法Ⅱ:铜铝混合物$→_{充分反应}^{足量B溶液}$测定剩余固体的质量.
方法Ⅰ:铜铝混合物$→_{充分反应}^{足量溶液A}$测定生成气体的体积
方法Ⅱ:铜铝混合物$→_{充分反应}^{足量B溶液}$测定剩余固体的质量.
| A. | 溶液A和溶液B均可以是盐酸或NaOH溶液 | |
| B. | 实验室中方案Ⅱ更便于实施 | |
| C. | 若溶液B选用浓硝酸,测得铜的质量分数偏大 | |
| D. | 方案一可能产生氢气,方案二可能剩余铜 |
10.下列关于天然气的叙述中,正确的是( )
| A. | 天然气是 理想的洁净能源 | |
| B. | 燃烧天然气产生的有害废气比氢气少 | |
| C. | 用天然气作燃料可解决温室效应问题 | |
| D. | 天然气、沼气的主要成分都是CH4 |
20.下列溶液中,Cl-的物质的量浓度最小的是( )
| A. | 1 L 1 mol•L-1的NaCl溶液 | B. | 0.1 L 2 mol•L-1的KCl溶液 | ||
| C. | 0.1 L 1 mol•L-1的MgCl2溶液 | D. | 10 mL 1 mol•L-1的AlCl3溶液 |
7.以下化学用语中,正确的是( )
| A. | 乙炔分子的结构式:H-C≡C-H | B. | 苯的结构简式: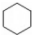 | ||
| C. | 乙醛分子的结构简式:CH3COH | D. | 甲烷分子的比例模型: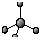 |
5.在同温同压下,某有机物一定条件下,与碳酸氢钠、钠均能产生气体,且生成的气体体积比(同温同压)为1:1,则此有机物可能是( )
| A. | HOOCCOOH | B. | HOCH2CH2CH2COOH | C. | HOCH2CH2OH | D. | CH3COOH |
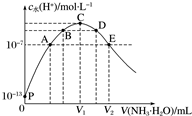 常温下向25mL盐酸中逐滴滴入0.1mol•L-1氨水,溶液中由水电离出的c水(H+)随滴入氨水的体积变化如图所示.
常温下向25mL盐酸中逐滴滴入0.1mol•L-1氨水,溶液中由水电离出的c水(H+)随滴入氨水的体积变化如图所示.