题目内容
1.元素性质呈周期性变化的根本原因是( )| A. | 元素质量数的递增 | B. | 元素的原子半径呈周期性变化 | ||
| C. | 金属性和非金属性呈周期性变化 | D. | 原子核外电子排布呈周期性变化 |
分析 元素的金属性和非金属性、元素的原子半径都属于元素的性质;元素的相对原子质量递增,但不呈现周期性的变化;结构决定性质,元素原子的核外电子排布的周期性变化导致元素性质的周期性变化.
解答 解:A、元素的质量数增大,但不呈现周期性的变化,则不能决定元素性质出现周期性变化,故A错误;
B、元素的原子半径属于元素的性质,原子半径周期性变化是原子的电子排布周期性变化的结果,故B错误;
C、元素金属性或非金属性都属于元素的性质,元素的金属性和非金属性的周期性变化是原子的电子排布周期性变化的结果,故C错误;
D、由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故D正确;
故选D.
点评 理解元素周期律的实质,元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果.

练习册系列答案
相关题目
11.2SO2+O2$?_{△}^{催化剂}$2SO3是工业制硫酸的一步重要反应,下列关于该反应的说法正确的是( )
| A. | 使用催化剂不影响反应速率 | B. | 升高体系温度能加快反应速率 | ||
| C. | 减小SO2的浓度能加快反应速率 | D. | 反应中SO2能100%转化为SO3 |
9.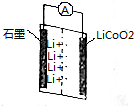 某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6═6C+LiCoO2.下列说法正确的是( )
某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6═6C+LiCoO2.下列说法正确的是( )
 某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6═6C+LiCoO2.下列说法正确的是( )
某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6═6C+LiCoO2.下列说法正确的是( )| A. | 石墨为正极 | |
| B. | 充电时,阳极质量不变 | |
| C. | 充电时,阴极反应式为xLi-xe-═xLi+ | |
| D. | 放电时,正极反应为xLi+Li1-xCoO2+xe-═LiCoO2 |
16.以下不属于化学键的是( )
| A. | 离子键 | B. | 共价键 | C. | 金属键 | D. | 分子间力 |
13.2015年12月12日,第21届联合国巴黎气候变化大会通过全球气候变化新协议.协议要求各国减少工业排放量的气体是( )
| A. | 二氧化硫 | B. | 氮的氧化物 | C. | 二氧化碳 | D. | 臭氧 |
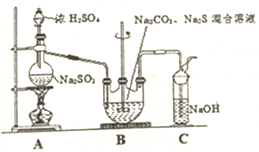 硫代硫酸钠晶体(Na2S203•5H20)俗名“大苏打”.己知它易溶于水,难溶于乙醇,加热和遇酸易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠晶体(Na2S203•5H20)俗名“大苏打”.己知它易溶于水,难溶于乙醇,加热和遇酸易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图: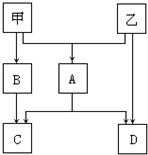 甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.
甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.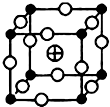 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途. 、
、 、
、 分别代表一种离子),晶胞边长为anm(1nm=10-9m),该晶体的化学式为KMgF3,该晶体的密度为$\frac{0.1993}{{a}^{3}}$g•cm-3.
分别代表一种离子),晶胞边长为anm(1nm=10-9m),该晶体的化学式为KMgF3,该晶体的密度为$\frac{0.1993}{{a}^{3}}$g•cm-3.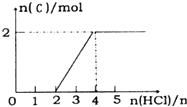 A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题: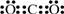 .
.