题目内容
氮元素是地球大气中含量最多的元素.
(1)氮元素基态原子核外电子成对电子数与未成对电子数之比为 .
(2)氨分子中氮原子与氢原子之间的作用力是 ,而在氨水中,分子间的作用力有 .
(3)甘氨酸(结构简式如图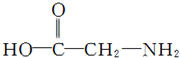 )是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是 .
)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是 .
(4)氮的氢化物除氨气外,还有联氨,其结构简式为NH2-NH2.在联氨分子中,N原子采用 杂化,联氨中的六个原子 (选填“在”或“不在”)同一个平面上.
(5)三聚氰胺(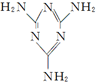 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(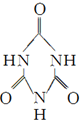 )后,三聚氰酸与三聚氰胺分子相互之间通过 结合,在肾脏内易形成结石.
)后,三聚氰酸与三聚氰胺分子相互之间通过 结合,在肾脏内易形成结石.
(1)氮元素基态原子核外电子成对电子数与未成对电子数之比为
(2)氨分子中氮原子与氢原子之间的作用力是
(3)甘氨酸(结构简式如图
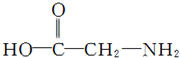 )是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是
)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是(4)氮的氢化物除氨气外,还有联氨,其结构简式为NH2-NH2.在联氨分子中,N原子采用
(5)三聚氰胺(
 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过考点:原子核外电子排布,化学键,原子轨道杂化方式及杂化类型判断,氢键的存在对物质性质的影响
专题:
分析:(1)书写N原子的核外电子排布式,根据各能级含有的电子数目及轨道数目判断,每个轨道最多容纳2个自旋方向相反的电子,且电子优先占据1个轨道;
(2)氨分子中氮原子与氢原子之间的作用力是共价键;分子与分子间是氢键和范德华力;
(3)甘氨酸分子与水分子之间存在氢键,所以甘氨酸易溶解于水;而戊烷与水分子不能形成氢键,所以戊烷却难溶解于水.
(4)根据价层电子对互斥理论确定分子空间构型和原子的杂化方式;
(5)三聚氰酸与三聚氰胺分子相互之间通过氢键结合.
(2)氨分子中氮原子与氢原子之间的作用力是共价键;分子与分子间是氢键和范德华力;
(3)甘氨酸分子与水分子之间存在氢键,所以甘氨酸易溶解于水;而戊烷与水分子不能形成氢键,所以戊烷却难溶解于水.
(4)根据价层电子对互斥理论确定分子空间构型和原子的杂化方式;
(5)三聚氰酸与三聚氰胺分子相互之间通过氢键结合.
解答:
解:(1)N原子的核外电子排布式为1s22s22p3,s能级有1个轨道,1s、2s电子为成对电子,2p能级有3个轨道,3个电子各占据1个轨道,是未成对电子,故未成对电子数与成对电子数之比为3:4,故答案为:4:3;
(2)氨分子中氮原子与氢原子之间的作用力是共价键;分子与分子间是氢键和范德华力,故答案为:共价键;氢键、范德华力;
(3)甘氨酸分子与水分子之间存在氢键,所以甘氨酸易溶解于水;而戊烷与水分子不能形成氢键,所以戊烷却难溶解于水,故答案为:甘氨酸分子与水分子之间存在氢键,而戊烷与水分子不能形成氢键;
(4)N2H4分子中氮原子的加成电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3,所以六个原子不可能在同一平面上,故答案为:sp3;不在;
(5)三聚氰酸与三聚氰胺分子相互之间通过氢键结合,故答案为:氢键.
(2)氨分子中氮原子与氢原子之间的作用力是共价键;分子与分子间是氢键和范德华力,故答案为:共价键;氢键、范德华力;
(3)甘氨酸分子与水分子之间存在氢键,所以甘氨酸易溶解于水;而戊烷与水分子不能形成氢键,所以戊烷却难溶解于水,故答案为:甘氨酸分子与水分子之间存在氢键,而戊烷与水分子不能形成氢键;
(4)N2H4分子中氮原子的加成电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3,所以六个原子不可能在同一平面上,故答案为:sp3;不在;
(5)三聚氰酸与三聚氰胺分子相互之间通过氢键结合,故答案为:氢键.
点评:本题考查了分子空间构型的判断、原子的杂化方式的判断等知识点,难度不大,注意分子空间构型的判断及原子杂化方式的判断是高考的热点.

练习册系列答案
相关题目
下列物质中,属于芳香烃且属于苯的同系物的是( )
A、 |
B、 |
C、 |
D、 |
元素X和Y在元素周期表中位于相邻的两个周期,X与Y原子核外电子数之和为19,Y原子核内质子数比X多3个,则下列叙述不正确的是( )
| A、X和Y的单质间形成的化合物的化学式可能是Y2X或Y2X2 |
| B、元素X形成的化合物的种类比元素Y形成的化合物种类多 |
| C、Y的单质与硫酸铜溶液反应时有气体放出并有蓝色沉淀生成 |
| D、X和Y在自然界中只能以化合态存在 |
下列溶液不能使溴水褪色的是( )
| A、亚硫酸钠溶液 |
| B、饱和二氧化硫溶液 |
| C、烧碱溶液 |
| D、氯化钠溶液 |
铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第六周期.Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+,下列推断正确的是( )
| A、Tl+的最外层有1个电子 |
| B、Tl+的还原性比Ag强 |
| C、Tl(OH)3为两性氢氧化物 |
| D、Tl3+的氧化性比Al3+弱 |
硫酸铵是农村常用的一种铵态氮肥,试回答下列问题:
下列物质不能跟硫酸铵肥料混合施用的是( )
下列物质不能跟硫酸铵肥料混合施用的是( )
| A、碳酸氢铵 |
| B、草木灰(K2CO3,其水溶液成强碱性) |
| C、过磷酸钙 |
| D、氯化钾 |
N2+3H2
2NH3是目前工业上合成氨的反应,下列关于该反应的说法正确的是( )
| 一定条件 |
| A、增加N2的浓度能加快反应速率 |
| B、降低体系温度能加快反应速率 |
| C、使用催化剂不影响反应速率 |
| D、若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
下列氢氧化物碱性由强到弱的顺序为( )
| A、LiOH、NaOH、KOH、CsOH |
| B、CsOH、KOH、NaOH、LiOH |
| C、KOH、CsOH、LiOH、NaOH |
| D、KOH、NaOH、CsOH、LiOH |
有一真空瓶的质量为m1g,该瓶充入氧气后总质量为m2g,在相同状况下,若充入某气体A后,总质量为m3g,则此A的摩尔质量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|