题目内容
下列氢氧化物碱性由强到弱的顺序为( )
| A、LiOH、NaOH、KOH、CsOH |
| B、CsOH、KOH、NaOH、LiOH |
| C、KOH、CsOH、LiOH、NaOH |
| D、KOH、NaOH、CsOH、LiOH |
考点:金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:根据金属性越强,最高价氧化物的水化物的碱性越强,以此来解答.
解答:
解:K、Na、Li、Cs在同一主族,
由同主族从上到下金属性在增强,
则金属性Cs>K>Na>Li,
金属性越强,最高价氧化物的水化物的碱性越强,
显然CsOH的碱性最强,碱性由强到弱的顺序为CsOH>KOH>NaOH>LiOH.
故选B.
由同主族从上到下金属性在增强,
则金属性Cs>K>Na>Li,
金属性越强,最高价氧化物的水化物的碱性越强,
显然CsOH的碱性最强,碱性由强到弱的顺序为CsOH>KOH>NaOH>LiOH.
故选B.
点评:本题考查元素周期律,明确金属性强弱是解答本题的关系,熟悉元素周期律即可解答,难度不大.

练习册系列答案
相关题目
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,下列关于X、Y、Z、W四种元素的描述,不正确的是( )
| A、原子序数:Y>X>Z>W |
| B、离子半径:X>Y>Z>W |
| C、原子最外层电子数:Z>W>Y>X |
| D、还原性:X>Y,W2->Z- |
下列化合物中阳离子半径与阴离子半径比值最小的是( )
| A、NaBr |
| B、CaI2 |
| C、MgI2 |
| D、KBr |
下列叙述正确的是( )
| A、同周期元素的原子半径以ⅦA族的为最大 |
| B、在周期表中零族元素的单质不全部是气体 |
| C、ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子 |
| D、所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等 |
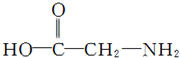 )是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是
)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是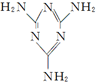 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(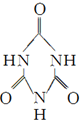 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过
 RCOOH+CO2↑②
RCOOH+CO2↑②
