题目内容
铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第六周期.Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+,下列推断正确的是( )
| A、Tl+的最外层有1个电子 |
| B、Tl+的还原性比Ag强 |
| C、Tl(OH)3为两性氢氧化物 |
| D、Tl3+的氧化性比Al3+弱 |
考点:同一主族内元素性质递变规律与原子结构的关系
专题:
分析:A、铊与铝同族,最外层有3个电子,以此判断Tl+离子的最外层电子数;
B、根据还原剂的还原性大于还原产物来分析;
C、同主族从上到下金属性增强,对应氢氧化物的碱性增强;
D、金属性越强,对应离子的氧化剂越弱.
B、根据还原剂的还原性大于还原产物来分析;
C、同主族从上到下金属性增强,对应氢氧化物的碱性增强;
D、金属性越强,对应离子的氧化剂越弱.
解答:
解:A、铊与铝同族,最外层有3个电子,则Tl+离子的最外层有2个电子,故A错误;
B、Tl3++2Ag═Tl++2Ag+,Ag为还原剂,Tl+为还原产物,则还原性Ag>Tl+,故B错误;
C、同主族从上到下金属性增强,对应氢氧化物的碱性增强,则Tl(OH)3的碱性强于氢氧化铝,则Tl(OH)3是碱性氢氧化物,故C错误;
D、金属性越强,对应离子的氧化剂越弱,同主族从上到下金属性增强,金属性:Tl>Al,则Tl3+的氧化性比Al3+弱,故D正确.
故选D.
B、Tl3++2Ag═Tl++2Ag+,Ag为还原剂,Tl+为还原产物,则还原性Ag>Tl+,故B错误;
C、同主族从上到下金属性增强,对应氢氧化物的碱性增强,则Tl(OH)3的碱性强于氢氧化铝,则Tl(OH)3是碱性氢氧化物,故C错误;
D、金属性越强,对应离子的氧化剂越弱,同主族从上到下金属性增强,金属性:Tl>Al,则Tl3+的氧化性比Al3+弱,故D正确.
故选D.
点评:本题考查铊与铝的性质比较,以及物质氧化性还原性的比较等问题,题目难度不大,注意把握比较问题的方法,题中易错点为D,注意结合方程式以及金属铝的性质进行比较.

练习册系列答案
相关题目
植物及其废弃物可制成乙醇燃料,下列关于乙醇燃料的说法不正确的是( )
| A、它是一种可再生能源 |
| B、粮食作物是制乙醇的重要原料 |
| C、乙醇易燃烧,污染小 |
| D、乙醇只能在实验室内作燃料 |
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( )
| A、利用质谱法 |
| B、利用金属钠 |
| C、利用红外光谱法 |
| D、利用核磁共振氢谱 |
下列说法不正确的是( )
| A、漂白粉的有效成分是次氯酸钙 |
| B、实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收 |
| C、钠、铁和铜一样都能在氯气中燃烧生成金属氯化物 |
| D、干燥的氯气可以使有色布条褪色 |
0.25mol A的质量是16g,则A的相对分子质量是( )
| A、32 g/mol |
| B、64 g/mol |
| C、32 |
| D、64 |


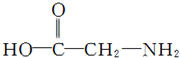 )是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是
)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是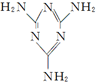 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(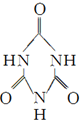 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过
