题目内容
某微粒的结构示意图为 ,试回答:
,试回答:
(1)当x-y=10时,该微粒为 (填“原子”、“阳离子”或“阴离子”).
(2)y=8时,某中性原子对应的单质分子式为 .
(3)写出金属铜与y=6的中性原子的元素最高价氧化物对应水化物浓溶液发生反应的化学方程式 .
(4)y=8的负一价离子电子式为 ,用电子式表示该元素与氢组成化合物的形成过程 .
 ,试回答:
,试回答:(1)当x-y=10时,该微粒为
(2)y=8时,某中性原子对应的单质分子式为
(3)写出金属铜与y=6的中性原子的元素最高价氧化物对应水化物浓溶液发生反应的化学方程式
(4)y=8的负一价离子电子式为
考点:原子结构示意图,化学方程式的书写
专题:
分析:(1)原子中核内质子数等于核外电子数;
(2)y=8时,核外电子共18个,中性原子中质子数等于核外电子数;
(3)y=6的中性原子,核外共有16个电子,质子数为16,为硫元素的原子,最高价氧化物的水化物为硫酸,铜与浓硫酸反应生成硫酸铜、二氧化硫和水;
(4)y=8的负一价离子,则其核内质子数为17,为氯离子,氢原子与氯原子通过共有1对电子形成氯化氢.
(2)y=8时,核外电子共18个,中性原子中质子数等于核外电子数;
(3)y=6的中性原子,核外共有16个电子,质子数为16,为硫元素的原子,最高价氧化物的水化物为硫酸,铜与浓硫酸反应生成硫酸铜、二氧化硫和水;
(4)y=8的负一价离子,则其核内质子数为17,为氯离子,氢原子与氯原子通过共有1对电子形成氯化氢.
解答:
解:(1)x-y=10时,x=10+y,核内质子数等于核外电子数,为原子,
故答案为:原子;
(2)y=8时,核外电子共18个,中性原子中质子数等于核外电子数,所以其质子数为18,为氩原子,形成单原子分子氩气,
故答案为:Ar;
(3)y=6的中性原子,核外共有16个电子,质子数为16,为硫元素的原子,最高价氧化物的水化物为硫酸,铜与浓硫酸反应生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑,
故答案为:Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑;
(4)y=8的负一价离子,则其核内质子数为17,为氯离子,电子式为: ,
,
氯化氢为共价化合物,由氢原子和氯原子通过共用电子对形成, ,
,
故答案为: ;
; ;
;
故答案为:原子;
(2)y=8时,核外电子共18个,中性原子中质子数等于核外电子数,所以其质子数为18,为氩原子,形成单原子分子氩气,
故答案为:Ar;
(3)y=6的中性原子,核外共有16个电子,质子数为16,为硫元素的原子,最高价氧化物的水化物为硫酸,铜与浓硫酸反应生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(4)y=8的负一价离子,则其核内质子数为17,为氯离子,电子式为:
 ,
,氯化氢为共价化合物,由氢原子和氯原子通过共用电子对形成,
 ,
,故答案为:
 ;
; ;
;
点评:本题考查了常见的化学用语,明确原子结构示意图意义、电子式的书写方法是解题关键,题目难度不大.

练习册系列答案
相关题目
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于 10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )

| A、由图甲知,B点SO2的平衡浓度为0.3mol?L-1 |
| B、由图甲知,A点对应温度下的平衡常数为80 |
| C、达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D、压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
某原电池反应原理示意图如图.下列有关该原电池的说法正确的是( )


| A、将电能转化为化学能 |
| B、电子从锌片经导线流向铜片 |
| C、一段时间后,铜片质量减轻 |
| D、锌片发生还原反应 |
下列反应的离子方程式正确的是( )
| A、碳酸钙与盐酸反应 CO32-+2H+=CO2↑+H2O |
| B、二氧化硫与氢氧化钠溶液反应 SO2+2OHˉ=SO42-+H2O |
| C、铁粉与氯化铁溶液反应 Fe+Fe3+=2Fe2+ |
| D、氯气与氢氧化钠溶液反应 Cl2+2OHˉ=Clˉ+ClOˉ+H2O |
尿素[CO(NH2)2]可用于电解制氢气,尿素属于( )
| A、有机物 | B、酸 | C、碱 | D、盐 |
下列反应中,水作为氧化剂的是( )
| A、2F2+2H2O=4HF+O2 |
| B、NaOH+HCl=NaCl+H2O |
| C、2Na+2H2O=2Na++2OH-+H2↑ |
| D、Cl2+H2O=HCl+HClO |
下列说法正确的是( )
| A、共价化合物中可能含有离子键 | ||||||
| B、Ca2+、K+、Cl-、S2--四种离子的半径依次减小 | ||||||
C、
| ||||||
| D、ⅥA族元素氧、硫、硒(Se)的位置从上至下,故H2O、H2S、H2Se稳定性依次减弱 |
下列离子方程式正确的是( )
| A、向NaHCO3溶液中加入少量的澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
| B、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
| C、醋酸溶液与水垢中的CaCO3反应:CaCO3+2 H+═Ca2++H2O+CO2↑ |
| D、氯化铝溶液中加入过量氨水:Al3++4 NH3?H2O═AlO2-+4NH4++2 H2O |
过滤还带灰制取单质碘的实验中,设计的操作正确的且能达到实验目的是( )
A、 装置,过滤海带灰浸取液 装置,过滤海带灰浸取液 |
B、 装置,在滤液中通入Cl2 装置,在滤液中通入Cl2 |
C、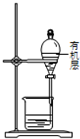 装置,先放出下层液体,再从下口放出有机层 装置,先放出下层液体,再从下口放出有机层 |
D、 装置,回收萃取剂苯并获得单质碘 装置,回收萃取剂苯并获得单质碘 |