题目内容
3.(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
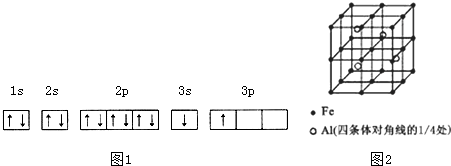
②ACl2分子中A的杂化类型为sp杂化,ACl2的空间构型为直线形.
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为8.
②写出一种与CN-互为等电子体的单质的电子式
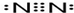 .
.③六氰合亚铁离子[Fe(CN)6]4-中不存在B.
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al-Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式Fe2Al.
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm.
分析 (1)①由电子轨道排布图可知,3s能级未填满就填充3p能级,而3s能级能量比3p能级低;
由表中电离能可知,二者第三电离能都剧增,原子最外层电子数为2,都为短周期元素,同主族自上而下第一电离能降低,故A为铍、B为Mg,镁价层电子排布为3s2;
②BeCl2分子中Be的成2个σ键,Be原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论判断Be原子杂化方式及微粒空间构型;
(2)①以体心立方堆积形成的金属铁中,该晶胞中8个顶点及体心上分别含有1个Fe原子;
②原子个数相等且价电子数相等的微粒互为等电子体;
③[Fe(CN)6]4-中存在配位键、极性键,共价单键为σ键,共价三键中存在σ键和π键;
(3)①该晶胞中Fe原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$+1+12×$\frac{1}{4}$=8,Al原子个数为4,所以Fe、Al原子个数之比=8:4=2:1;
②该晶胞棱长=$\root{3}{\frac{\frac{M}{{N}_{A}}×4}{ρ}}$cm,此合金中最近的两个Fe原子之间的距离为晶胞棱长的一半.
解答 解:(1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,3s能级能量比3p能级低,所以违背能量最低原理;
由表中电离能可知,二者第三电离能都剧增,原子最外层电子数为2,都为短周期元素,同主族自上而下第一电离能降低,故A为铍、B为Mg,镁价层电子排布为3s2,处于周期表中s区,
故答案为:能量最低原理;s;
②BeCl2分子中Be的成2个σ键,价层电子对个数是2,所以采取sp杂化,为直线形,
故答案为:sp杂化;直线形;
(2)①以体心立方堆积形成的金属铁中,该晶胞中8个顶点及体心上分别含有1个Fe原子,所以其配位数是8,故答案为:8;
②原子个数相等且价电子数相等的微粒互为等电子体,氢氰根离子中原子个数是2价电子数是10,与氮气互为等电子体,氮气分子中氮原子之间共用3对电子,其电子式为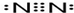 ,故答案为:
,故答案为: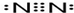 ;
;
③[Fe(CN)6]4-中存在配位键、极性键,共价单键为σ键,共价三键中存在σ键和π键,该微粒中碳原子和N原子之间存在配位键,C、N原子之间存在极性共价键及σ键和π键,所以不存在非极性键,故选B;
(3)①该晶胞中Fe原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$+1+12×$\frac{1}{4}$=8,Al原子个数为4,所以Fe、Al原子个数之比=8:4=2:1,所以其化学式为Fe2Al,故答案为:Fe2Al;
②该晶胞棱长=$\root{3}{\frac{\frac{M}{{N}_{A}}×4}{ρ}}$cm,此合金中最近的两个Fe原子之间的距离为晶胞棱长的一半=$\frac{1}{2}$×$\root{3}{\frac{\frac{M}{{N}_{A}}×4}{ρ}}$cm=$\frac{1}{2}$×$\root{3}{\frac{\frac{139}{{N}_{A}}×4}{ρ}}$cm=$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm,
故答案为:$\root{3}{\frac{139}{2ρ{N}_{A}}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、等电子体、化学键判断、微粒空间构型等知识点,侧考查学生知识综合应用及空间想象、计算能力,难点是晶胞计算,注意:配位键属于共价键.

 阅读快车系列答案
阅读快车系列答案| A. | 同族元素,随着核外电子层数的增加,I1逐渐增大 | |
| B. | 通常情况下,对于同一种元素的原子,其电离能I1<I2<I3 | |
| C. | 同周期元素,总体变化趋势是随着核电荷数的增加,I1增大 | |
| D. | 通常情况下,电离能越小,元素的金属性越强 |
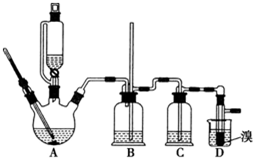 实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CH
实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CHCH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚. 用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如图所示:
有关数据列表如下
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到 170℃左右,其最主要目 的是d;(填正确选项前的字母)
a.引发反应b.加快反应速度c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置 C 中应加入c,其目的是吸收反应中可能生成的酸 性气体:(填正确选项前的字母)
a.水b.浓硫酸 c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层 (填“上”、“下”);
(5)若产物中有少量未反应的 Br2,最好用b洗涤除去;(填正确选 项前的字母)
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置 D,其主要目的是冷却可避免溴的大量挥发; 但又不能过度冷却 (如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| A. | 称量样品→加热→冷却→称量CuO | |
| B. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 | |
| C. | 称量样品→加热→冷却→称量Cu(NO3)2 | |
| D. | 称量样品→加NaOH→过滤→加热→冷却→称量CuO |
| A. | 制乙烯时,用排水法或向上排空气法收集气体 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| C. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
 某化学活动小组设计实验(装置如图)验证氯、溴、碘及其化合物的有关物质.在硬质玻璃管中的A、B、C三处依次放置湿润的蓝色石蕊试纸、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如图所示),由左端通入足量氯气,回答下列问题:
某化学活动小组设计实验(装置如图)验证氯、溴、碘及其化合物的有关物质.在硬质玻璃管中的A、B、C三处依次放置湿润的蓝色石蕊试纸、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如图所示),由左端通入足量氯气,回答下列问题: