题目内容
7.用如图装置进行浓硫酸和木炭反应的实验,并检验有CO2和SO2两种气体生成.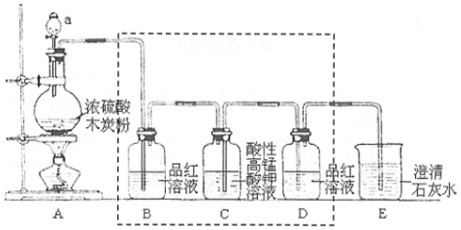
回答下列问题:
(1)仪器a的名称为分液漏斗,A装置中发生反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)虚线框内有一处错误,请指出C中导气管应该长进短出,装置B的作用是验证有二氧化硫生成.
(3)装置C中酸性KMnO4溶液用于除去SO2,其目的是甲.(填序号)
甲:防止SO2干扰CO2的检验 乙:吸收CO2气体 丙:检验SO2
(4)装置E的现象是石灰水变浑浊,E中发生反应的离子方程式为CO2+Ca2++2OH-═CaCO3↓+H2O.
分析 A中加热条件下,浓硫酸和碳发生氧化还原反应生成二氧化碳、二氧化硫和水,B中品红用于检验二氧化硫,C用于除去二氧化硫,二氧化硫与高锰酸钾发生氧化还原反应,但导管应长进短出,D用于检验品红是否除尽,E可用于检验是否生成二氧化碳,可观察到石灰水变浑浊,以此解答该题.
解答 解:(1)由装置可知a为分液漏斗,A装置中发生反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,故答案为:分液漏斗;C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)C装置气体应从长导管进入,防止压强过大,将溶液排出,B中品红可减压有二氧化硫生成,故答案为:C中导气管应该长进短出;验证有二氧化硫生成;
(3)二氧化硫、二氧化碳都可使石灰水变浑浊,检验二氧化碳前应先除尽二氧化硫,可用高锰酸钾除去,故答案为:甲;
(4)装置E中含有石灰水,可与二氧化碳反应生成碳酸钙沉淀,可观察到澄清石灰水变浑浊,反应的离子方程式为CO2+Ca2++2OH-═CaCO3↓+H2O,
故答案为:石灰水变浑浊;CO2+Ca2++2OH-═CaCO3↓+H2O.
点评 本题考查浓硫酸的性质实验,为高考常见题型和高频考点,侧重考查学生的分析能力和实验能力,注意把握浓硫酸的强氧化性,题目难度中等,明确气体的性质及检验的先后顺序为解答关键,注意掌握浓硫酸的化学性质,能够正确书写浓硫酸与碳反应化学方程式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列说法中不正确的是( )
| A. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大最共存 | |
| B. | 在含有0.1mol/L Fe3+的溶液中:SCN-、Cl-、K+不能大最共存 | |
| C. | 在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-变化最小 | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
12.某稀溶液中可能含有Na+、Ba2+、Fe2+、H+、OH-、NO3-、SO42-中的若干种,向该溶液中加入铝粉后,溶液中有Al3+生成,下列判断中正确的是( )
| A. | 溶液中一定含有H+、SO42- | B. | 溶液中一定没有OH-、Fe2+、NO3- | ||
| C. | 溶液中可能含有Na+、Fe2+、Ba2+ | D. | 一定有H2生成 |
19.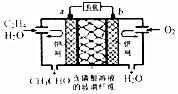 中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途.如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )
中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途.如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )
 中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途.如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )
中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途.如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | 该电池电极a为正极,b为负极 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 负极反应式为:CH2═CH2-2e-+H2O═CH3CHO+2H+ | |
| D. | b电极有2.24LO2反应,溶液中有0.4molH+迁移到b电极上反应 |
16.为了检验某固体物质中是否含有NH4+,一定用不到的试剂或试纸是( )
| A. | NaOH溶液 | B. | 浓盐酸 | C. | 稀硫酸 | D. | 红色石蕊试纸 |
17.下列事实不能用化学平衡移动原理解释的是( )
| A. | 收集氯气用排饱和食盐水的方法 | |
| B. | 加压条件下有利于SO2和O2反应生成SO3 | |
| C. | 将NO2球浸泡在热水中颜色加深 | |
| D. | 加催化剂,使N2和H2在一定的条件下转化为NH3 |
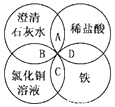 铁、稀硫酸、Ba(OH)2溶液、CuSO4溶液是中学化学常见的物质,这四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质之间可能发生的反应,请回答下列问题:
铁、稀硫酸、Ba(OH)2溶液、CuSO4溶液是中学化学常见的物质,这四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质之间可能发生的反应,请回答下列问题: