题目内容
10.向20ml1mol/LAlCl3溶液中加入20ml或40ml某浓度氢氧化钠溶液产生相同质量的沉淀,则此氢氧化钠溶液物质的量浓度为( )| A. | 1.2mol/L | B. | 1.4mol/L | C. | 1.7mol/L | D. | 1.9mol/L |
分析 向20ml1mol/LAlCl3溶液中加入20ml或40ml某浓度氢氧化钠溶液产生相同质量的沉淀,说明加入20mL氢氧化钠溶液时氢氧化钠完全反应生成氢氧化铝沉淀,加入的40mL氢氧化钠溶液后,氯化铝完全反应生成氢氧化铝沉淀和偏铝酸钠;设出生成氢氧化铝沉淀的物质的量及氢氧化钠溶液的浓度,然后根据反应Al3++3OH-═Al(OH)3↓、Al3++4OH-═AlO2-+2H2O及题干数据列式计算.
解答 解:设生成氢氧化铝沉淀的物质的量为y,该氢氧化钠溶液的浓度为x,
加入20mL氢氧化钠溶液与加热40mL氢氧化钠溶液生成的沉淀的量相同,说明加入20mL氢氧化钠溶液时氢氧化钠完全转化成氢氧化铝沉淀,而加入40mL氢氧化钠溶液时氯化铝完全反应,生成氢氧化铝和偏铝酸钠的物质的量分别为y、(0.02-y),
根据反应Al3++3OH-═Al(OH)3↓可知:①0.02x=3y,
根据反应Al3++4OH-═AlO2-+2H2O可知:②0.04x=3y+4(0.02-y),
联立①②解得:y≈0.0114mol、x≈1.7mol/L,
故选C.
点评 本题考查了离子方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
20.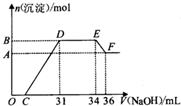 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )| A. | D点溶液中存在:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-) | |
| B. | EF段发生化学反应的离子方程式为:Al(OH)3+OH-=Al(OH)4- | |
| C. | 原溶液中n(NH4+)=0.012mol | |
| D. | 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
1.下列实验现象可用同一原理解释的是( )
| A. | 向品红溶液中分别通入SO2和Cl2,品红均褪色 | |
| B. | 向裂化汽油和苯乙烯中分别加入溴水,溴水均褪色 | |
| C. | 分别加热盛有氯化铵和单质碘的试管,内壁或管口均有固体凝结 | |
| D. | 分别向鸡蛋白溶液中加入饱和硫酸铵溶液和甲醛溶液,均有固体析出 |
3.H2O2是实验室常用的一种化学试剂.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)实验①和②的目的是_探究H2O2溶液的浓度的变化对分解速率的影响,
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图甲.分析图甲能够得出的结论是图象显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱
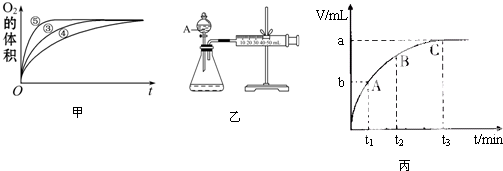
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如图乙所示的实验装置进行实验.
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率.
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O;
(5)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图丙所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的瞬时速率.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图甲.分析图甲能够得出的结论是图象显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱

(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如图乙所示的实验装置进行实验.
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率.
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O;
(5)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图丙所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的瞬时速率.
10.草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
【实验1】甲同学用8.00mL 0.001mol/L KMnO4溶液与5.00mL 0.01mol/LH2C2O4溶液反应,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)如果研究温度对化学反应速率的影响,可用实验Ⅰ和Ⅱ作对比(用Ⅰ~Ⅲ表示).
(2)对比实验Ⅰ和Ⅲ,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅲ中加入2.00mL蒸馏水的目的是确保实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同.
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
(1)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂的影响.
(2)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
【实验1】甲同学用8.00mL 0.001mol/L KMnO4溶液与5.00mL 0.01mol/LH2C2O4溶液反应,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | KMnO4溶液 /ml | H2C2O4溶液 /ml | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL 蒸馏水 |
(2)对比实验Ⅰ和Ⅲ,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅲ中加入2.00mL蒸馏水的目的是确保实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同.
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
(1)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂的影响.
(2)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
8.银锌钮扣高能电池放电时的反应为:Zn+Ag2O═ZnO+2Ag,下列说法中不正确的是( )
| A. | 若电解质溶液为KOH溶液,则电池工作一段时间后pH有明显变化 | |
| B. | Zn作负极,被氧化 | |
| C. | Ag2O在正极上发生还原反应 | |
| D. | 电解质溶液中的阴离子移向负极 |
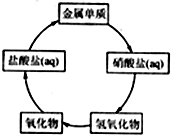 在一定条件下,五种含有同种金属元素的单质或其化合物,能按有图箭头方向实现一步转化(不含电解),该金属元素可能是 ( )
在一定条件下,五种含有同种金属元素的单质或其化合物,能按有图箭头方向实现一步转化(不含电解),该金属元素可能是 ( )
 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题: