��Ŀ����
ij�������������ȷֽ�IJ���Ϊ����NԪ�صĹ������ʺ�NO2��O2���壮
��1���ý������������ȷֽ��������NO2��O2�����ʵ���֮��Ϊ6��1�������Ԫ�صļ�̬�ڷ�Ӧ������ ��ѡ����ߡ��������͡����䡱����
��2���ý������������ȷֽ����NO2��O2�����ʵ���֮�ȵ���Сֵ�� ��
��3����ȡmg Cu��NO3��2����ˮ�ľ��壬ǿ��ʹ��ֽ⣬�õ�NO2��O2 ��ng���壮��������ˮ������պ����������ʣ�࣬ͬʱ�õ�500mL��Һ�����������ijɷֿ����� ���û�ѧʽ��ʾ����������Һ�����ʵ���Ũ���� ���ú�m�Ĵ���ʽ��ʾ����
��4����m=3.76��n=1.52����ͨ������ȷ����������ijɷֺ�������
��1���ý������������ȷֽ��������NO2��O2�����ʵ���֮��Ϊ6��1�������Ԫ�صļ�̬�ڷ�Ӧ������
��2���ý������������ȷֽ����NO2��O2�����ʵ���֮�ȵ���Сֵ��
��3����ȡmg Cu��NO3��2����ˮ�ľ��壬ǿ��ʹ��ֽ⣬�õ�NO2��O2 ��ng���壮��������ˮ������պ����������ʣ�࣬ͬʱ�õ�500mL��Һ�����������ijɷֿ�����
��4����m=3.76��n=1.52����ͨ������ȷ����������ijɷֺ�������
���㣺�������ʵ��ۺ�Ӧ��,������ԭ��Ӧ�ļ���
ר�⣺������
��������1��ij���������������ȷֽ�����NO2��O2����Ԫ�ػ��ϼ���+5�۽���Ϊ+4�ۣ���Ԫ�ػ��ϼ���-2������Ϊ0�ۣ�����NO2�� O2�����ʵ���֮��Ϊ6��1�����㵪ԭ�ӵõ��ĵ��ӡ���ԭ��ʧȥ�ĵ��ӣ����ݵ���ת���غ㣬�жϽ���Ԫ�ػ��ϼ۱仯��
��2�������������ֽ���ɷ����������仯Ϊ����ʱ����NO2��O2�����ʵ���֮�ȵ���С��
��3��NO2��O2ͨ��ˮ�з���4NO2+O2+2H2O=HNO3�������ǡ�÷�Ӧ�������ɹ���ΪCuO������ʣ�࣬ӦΪ��������Ԫ�ػ��ϼ�����������ȿ�֪��CuԪ�ػ��ϼ۽��ͣ���Ӧ����Cu2O��NԪ��ȫ����NO2�������ɣ����NԪ���غ����Ũ�ȣ�
��4���������غ�ĽǶ���ʽ���㣮
��2�������������ֽ���ɷ����������仯Ϊ����ʱ����NO2��O2�����ʵ���֮�ȵ���С��
��3��NO2��O2ͨ��ˮ�з���4NO2+O2+2H2O=HNO3�������ǡ�÷�Ӧ�������ɹ���ΪCuO������ʣ�࣬ӦΪ��������Ԫ�ػ��ϼ�����������ȿ�֪��CuԪ�ػ��ϼ۽��ͣ���Ӧ����Cu2O��NԪ��ȫ����NO2�������ɣ����NԪ���غ����Ũ�ȣ�
��4���������غ�ĽǶ���ʽ���㣮
���
�⣺��1��ij���������������ȷֽ�����NO2��O2����Ԫ�ػ��ϼ���+5�۽���Ϊ+4�ۣ���Ԫ�ػ��ϼ���-2������Ϊ0�ۣ����ɵĶ������������������ʵ���֮��Ϊ6��1��
��NO2�� O2�����ʵ����ֱ�Ϊ6mol��1mol����ԭ�ӵõ��ĵ������ʵ���Ϊ6mol����5-4��=6mol����ԭ��ʧȥ�ĵ���Ϊ1mol��2��[0-��-2��]=4mol��
������ԭ��Ӧ�У���ʧ������ĿӦ��ȣ���������ϼ�Ӧ���ߣ�ʧ���ӱ�������
�ʴ�Ϊ�����ߣ�
��2���������˳������ý�����K-Na�������������κ�O2��2NaNO3=2NaNO2+O2�ϻ��ý��� ��Mg-Cu�� ���ɽ��������NO2��O2��2Cu��NO3��2=2CuO+4NO2 +O2���Խ�����Cu֮��ģ����ɽ������ʡ�NO2��O2��2AgNO3=2Ag+2NO2+O2 ��
ij���������������ȷֽ�����NO2��O2����Ԫ�ػ��ϼ���+5�۽���Ϊ+4�ۣ���Ԫ�ػ��ϼ���-2������Ϊ0�ۣ��������ϼ۽���Խ�����NO2��O2�����ʵ���֮��ԽС�����ɵ��ʽ���������࣬��ֻ���Ƕ��۽�������Hg��NO3 ��2 =Hg+2NO2+O2 ����СֵΪ2��1��
�ʴ�Ϊ��2��1��
��3��NO2��O2ͨ��ˮ�з���4NO2+O2+2H2O=HNO3�������ǡ�÷�Ӧ�������ɹ���ΪCuO������ʣ�࣬ӦΪ��������Ԫ�ػ��ϼ�����������ȿ�֪��CuԪ�ػ��ϼ۽��ͣ���Ӧ����Cu2O����ʣ��������ΪCuO��Cu2O�Ļ�����Cu2O��
NԪ��ȫ����NO2�������ɣ�ͨ��ˮ�з���4NO2+O2+2H2O=HNO3��n��HNO3��=n��NO2��=2n��Cu��NO3��2��=
=
mol��
������Һ�����ʵ���Ũ����c��HNO3��=
=
mol/L��
�ʴ�Ϊ��CuO��Cu2O�Ļ�����Cu2O��
mol/L��
��4����m=3.76��n=1.52����
n��Cu��NO3��2��=
=0.02mol����n��NO2��=0.04mol��
ȡȫ������Cu2O����m��Cu2O��=0.01mol��144g/mol=1.44g��1.52g����˵������ΪCuO��Cu2O�Ļ���
��������xmolCuO��ymolCu2O��
��֮��x=0.01��y=0.005��
��m��CuO��=0.8g��m��Cu2O��=0.72g��
��m��Cu2O��=0.72g��m��CuO��=0.8g��
��NO2�� O2�����ʵ����ֱ�Ϊ6mol��1mol����ԭ�ӵõ��ĵ������ʵ���Ϊ6mol����5-4��=6mol����ԭ��ʧȥ�ĵ���Ϊ1mol��2��[0-��-2��]=4mol��
������ԭ��Ӧ�У���ʧ������ĿӦ��ȣ���������ϼ�Ӧ���ߣ�ʧ���ӱ�������
�ʴ�Ϊ�����ߣ�
��2���������˳������ý�����K-Na�������������κ�O2��2NaNO3=2NaNO2+O2�ϻ��ý��� ��Mg-Cu�� ���ɽ��������NO2��O2��2Cu��NO3��2=2CuO+4NO2 +O2���Խ�����Cu֮��ģ����ɽ������ʡ�NO2��O2��2AgNO3=2Ag+2NO2+O2 ��
ij���������������ȷֽ�����NO2��O2����Ԫ�ػ��ϼ���+5�۽���Ϊ+4�ۣ���Ԫ�ػ��ϼ���-2������Ϊ0�ۣ��������ϼ۽���Խ�����NO2��O2�����ʵ���֮��ԽС�����ɵ��ʽ���������࣬��ֻ���Ƕ��۽�������Hg��NO3 ��2 =Hg+2NO2+O2 ����СֵΪ2��1��
�ʴ�Ϊ��2��1��
��3��NO2��O2ͨ��ˮ�з���4NO2+O2+2H2O=HNO3�������ǡ�÷�Ӧ�������ɹ���ΪCuO������ʣ�࣬ӦΪ��������Ԫ�ػ��ϼ�����������ȿ�֪��CuԪ�ػ��ϼ۽��ͣ���Ӧ����Cu2O����ʣ��������ΪCuO��Cu2O�Ļ�����Cu2O��
NԪ��ȫ����NO2�������ɣ�ͨ��ˮ�з���4NO2+O2+2H2O=HNO3��n��HNO3��=n��NO2��=2n��Cu��NO3��2��=
| mg |
| 188g/mol |
| m |
| 94 |
������Һ�����ʵ���Ũ����c��HNO3��=
| ||
| 0.1L |
| 5m |
| 47 |
�ʴ�Ϊ��CuO��Cu2O�Ļ�����Cu2O��
| 5m |
| 47 |
��4����m=3.76��n=1.52����
n��Cu��NO3��2��=
| 3.76g |
| 188g/mol |
ȡȫ������Cu2O����m��Cu2O��=0.01mol��144g/mol=1.44g��1.52g����˵������ΪCuO��Cu2O�Ļ���
��������xmolCuO��ymolCu2O��
|
��֮��x=0.01��y=0.005��
��m��CuO��=0.8g��m��Cu2O��=0.72g��
��m��Cu2O��=0.72g��m��CuO��=0.8g��
���������⿼��������ԭ��Ӧ�ļ��㣬Ϊ�߿���Ƶ���㣬�����ڻ����������������յĿ��飬ע��������ԭ��Ӧ�л��ϼ�����������ȣ����ݵ���ת���غ��ж��ǹؼ���ע���غ�˼���Ӧ�ã��Ѷ��еȣ�

��ϰ��ϵ�д�
 ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д� �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д� ��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
�����Ŀ
�ñ���NaOH�ζ�δ֪Ũ�ȵ����ᣬѡ�÷�̪Ϊָʾ������ɲⶨ���ƫ�ߵ�ԭ������ǣ�������
| A�����Ʊ���Һ�����������л���Na2CO3���� |
| B���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ |
| C��ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ |
| D���ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ |
| E��δ�ñ�Һ��ϴ��ʽ�ζ��� |
�ṹ��ʽΪCH3CH2OH�����ʲ��ܹ����ڣ�������
| A����� | B������������ |
| C������ | D�������� |
��50mL 18mol/L�������м���������ͭƬ�����ȣ���ַ�Ӧ����ԭ����������ʵ�����������
| A����0.45mol |
| B������0.45mol |
| C����0.45mol ��0.9mol֮�� |
| D������0.9mol |
��֪c��NH4Cl����0.1mol?L-1ʱ����Һ��pH��5.1������0.1mol?L-1����ζ�10mL 0.05mol?L-1��ˮ���ü�����ָʾ�����ﵽ�յ�ʱ�����������Ӧ�ǣ�������
| A��10 mL |
| B��5 mL |
| C������5 mL |
| D����5 mL |
���������ӵ���Һ�зֱ����NaOH���壨��Һ������䣩������������Ũ�ȼ�С���ǣ�������
| A��Cl- |
| B��OH- |
| C��AlO2- |
| D��HCO3- |
���ܱ�������A��B��Ӧ����C���䷴Ӧ���ʷֱ���v��A����v��B����v��C����ʾ����֪v��A����v��B����v��C��֮�������¹�ϵ3v��A��=2v��B����3v��C��=2v��B������˷�Ӧ�ɱ�ʾΪ��������
| A��2A+3B=2C |
| B��A+3B=2C |
| C��3A+B=2C |
| D��A+B=C |
��ͼװ�÷ֱ�ͨ��һ��ʱ�����Һ���������ӵ��ǣ�������
A��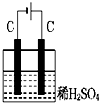 |
B��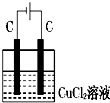 |
C��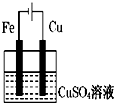 |
D��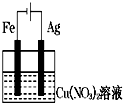 |
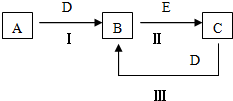 A��B��C��D��EΪ��ѧ��ѧ�����ĵ��ʻ���ת����ϵ��ͼ��ʾ��
A��B��C��D��EΪ��ѧ��ѧ�����ĵ��ʻ���ת����ϵ��ͼ��ʾ��