题目内容
17.欲使Ca(OH)2悬浊液变澄清,可以选择加入的试剂是( )| A. | CaCl2浓溶液 | B. | NaOH浓溶液 | C. | NH4Cl浓溶液 | D. | MgCl2浓溶液 |
分析 Ca(OH)2悬浊液中存在Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),若要使悬浊液变澄清,需要使沉淀溶解平衡向正方向移动,据此分析.
解答 解:Ca(OH)2悬浊液中存在Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),若要使悬浊液变澄清,需要使沉淀溶解平衡向正方向移动,
A.加CaCl2浓溶液,Ca2+的浓度增大,沉淀溶解平衡向逆方向移动,沉淀增多,故A错误;
B.加NaOH浓溶液浓溶液,OH-的浓度增大,沉淀溶解平衡向逆方向移动,沉淀增多,故B错误;
C.NH4Cl浓溶液,铵根离子结合溶液中的氢氧根离子,氢氧根离子浓度减小,沉淀溶解平衡向正方向移动,悬浊液变澄清,故C正确;
D.MgCl2浓溶液,Ca(OH)2会转化为氢氧化镁沉淀,溶液不能变澄清,故D错误.
故选C.
点评 本题考查了沉淀溶解平衡的移动,题目难度不大,侧重于考查学生对基础知识的应用能力,注意把握影响沉淀溶解平衡的移动的因素.

练习册系列答案
相关题目
7.分类方法在化学学科的发展中起到重要的作用,下列完全正确的是( )
| A | B | C | D | |
| 强电解质 | AgCl | SO3 | 醋酸 | 熔融NaOH |
| 弱电解质 | 晶体桂 | BaSO4 | HF | Fe(OH)3 |
| 非电解质 | CH4 | 液氨 | C2H5OH | C02 |
| A. | A | B. | B | C. | C | D. | D |
8.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 标准状况下,33.6 LSO3中含有氟原子的数目为1.5NA | |
| B. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| C. | 7.8 g Na2O2中含有的阴离子数为0.2NA | |
| D. | 1 molCl2参加反应转移电子数一定为2NA |
5.下列各组离子中,在给定条件下能大量共存的是( )
| A. | 通入足量的二氧化碳后的溶液中Na+、$Al{O_2}^-、$$CH_3^{\;}CO{O^-}、$$C{O_3}^{2-}$ | |
| B. | 无色溶液中$M{g^{2+}}、Mn{O_4}^-、S{O_4}^{2-}、{I^-}$ | |
| C. | 酸性溶液中可能大量存在 $N{a^+}、Cl{O^-}、S{O_4}^{2-}、{I^-}$ | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中$N{H_4}^+、C{l^-}$、Al3+、$N{O_3}^-$ |
2.等物质的量的含氮化合物发生下列反应,转移电子数最少的是( )
| A. | NO2和H2O | B. | NH3和O2 | C. | Fe和稀HNO3 | D. | NO和O2 |
6.下列解释事实的化学用语,正确的是( )
| A. | 在空气中切开金属钠,光亮表面变暗:2Na+O2═Na2O2 | |
| B. | 向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3++3OH-═Al(OH)3↓ | |
| C. | 将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2 | |
| D. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH═Na2SiO3+H2O |
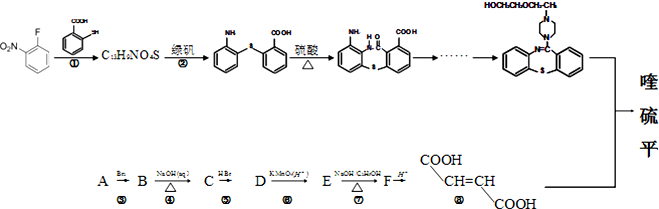
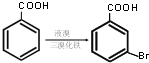 写出以甲苯为原料制备
写出以甲苯为原料制备 的合成路线.
的合成路线.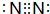 ;构成AlN的微粒是Al原子和N原子.
;构成AlN的微粒是Al原子和N原子.