题目内容
10.工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:回答下列问题: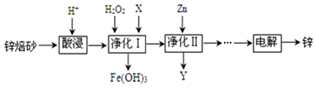
(1)ZnFe2O4是一种性能优良的软磁材料,也是一种催化剂,能催化烯类有机物氧化脱氢等反应.
①ZnFe2O4中Fe的化合价是+3,从物质分类角度说,ZnFe2O4属于盐(填“酸”、“碱”或“盐”).
②工业上利用反应ZnFe2(C2O4)3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4.该反应中氧化产物是ZnFe2O4、CO2(填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是4mol.
(2)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率.为达到这一目的,还可采用的措施是增大硫酸的浓度或升高温度、空气搅拌等(任答一条);已知ZnFe2O4能溶于酸,则酸浸后溶液中存在的金属离子有Zn2+、Fe3+、Fe2+、Cu2+.
(3)净化Ⅰ中H2O2参与反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O;试剂X的作用是调节溶液的pH,促进Fe3+水解.
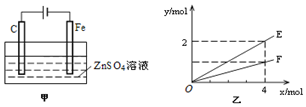
(4)钢铁镀锌是钢铁防护的一种有效方法.按图甲装置进行模拟铁上镀锌的实验,实验结果如图乙所示.乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量.
①C电极的电极反应式为4OH--4e-=O2↑+2H2O.
②E可以表示的量是消耗水的物质的量、生成Zn的物质的量、生成硫酸的物质的量等(任写一种).
分析 将锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)酸浸,发生反应ZnFe2O4+8H+=Zn2++2Fe3++4H2O、ZnO+2H+=Zn2++H2O、FeO+2H+=Fe2++H2O、CuO+2H+=Cu2++H2O,向溶液中加入双氧水,发生反应2Fe2++2H++H2O2=2 Fe3++2H2O,调节溶液的pH将Fe3+转化为Fe(OH)3沉淀,调节溶液pH时不能引进新的杂质,可以用ZnO,所以X为ZnO,然后向溶液中加入Zn,发生反应Cu2++Zn=Zn2++Cu,然后过滤,所以Y中含有Cu,最后电解得到Zn,
(1)①ZnFe2O4中锌的化合价+2价,氧元素化合价-2价,结合化合价代数和为0计算得到Fe的化合价;
②工业上利用反应ZnFe2(C2O4)3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4.反应过程中铁元素化合价+2价变化为+3价,碳元素化合价+3价变化为+4价好+2价;
(2)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率.为达到这一目的,还可采用的措施是增大硫酸的浓度或升高温度、空气搅拌等,已知ZnFe2O4能溶于酸,则酸浸后溶液中存在的金属离子有,氧化锌溶解得到锌离子、氧化亚铁溶解得到亚铁离子、氧化铜溶解得到铜离子、ZnFe2O4能溶于酸得到铁离子;
(3)化Ⅰ中H2O2参与反应是双氧水具有氧化性,能将亚铁离子氧化为铁离子,试剂X的作用是调节溶液PH,促进Fe3+水解生成氢氧化铁沉淀除去;
(4)由甲可知,为电解装置,C为阳极,发生4OH--4e-=O2↑+2H2O,Cu为阴极,发生Cu2++2e-=Cu;由乙可知,转移4mol电子生成2molE,E为Cu,生成1molF,F为氧气,以此来解答.
解答 解:将锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)酸浸,发生反应ZnFe2O4+8H+=Zn2++2Fe3++4H2O、ZnO+2H+=Zn2++H2O、FeO+2H+=Fe2++H2O、CuO+2H+=Cu2++H2O,向溶液中加入双氧水,发生反应 2Fe2++2H++H2O2=2 Fe3++2H2O,调节溶液的pH将Fe3+转化为Fe(OH)3沉淀,调节溶液pH时不能引进新的杂质,可以用ZnO,所以X为ZnO,然后向溶液中加入Zn,发生反应Cu2++Zn=Zn2++Cu,然后过滤,所以Y中含有Cu,最后电解得到Zn,
(1)①ZnFe2O4中锌的化合价+2价,氧元素化合价-2价,结合化合价代数和为0计算得到Fe的化合价,+2+x×2+(-2)×4=0,x=+3,从物质分类角度说,物质是酸根离子和金属阳离子构成,所以ZnFe2O4属于盐,
故答案为:+3;盐;
②工业上利用反应ZnFe2(C2O4)3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4.反应过程中铁元素化合价+2价变化为+3价,碳元素化合价+3价变化为+4价好+2价,则氧化产物为:ZnFe2O4、CO2,每生成1mol ZnFe2O4,碳元素化合价+3价变化为+2价降低得到电子,每生成1mol ZnFe2O4,生成4molCO转移电子的物质的量是4mol,
故答案为:ZnFe2O4、CO2;4mol;
(2)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率.为达到这一目的,还可采用的措施是增大硫酸的浓度或升高温度、空气搅拌等,已知ZnFe2O4能溶于酸,则酸浸后溶液中存在的金属离子有,氧化锌溶解得到锌离子、氧化亚铁溶解得到亚铁离子、氧化铜溶解得到铜离子、ZnFe2O4能溶于酸得到铁离子,所以得到的金属离子有:Zn2+、Fe3+、Fe2+、Cu2+,
故答案为:增大硫酸的浓度或升高温度、空气搅拌等;Zn2+、Fe3+、Fe2+、Cu2+;
(3)净化Ⅰ中H2O2参与反应是双氧水具有氧化性,能将亚铁离子氧化为铁离子,离子方程式为:H2O2+2Fe2++2H+═2Fe3++2H2O,试剂X的作用是调节溶液PH,促进Fe3+水解生成氢氧化铁沉淀除去,
故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;调节溶液的pH,促进Fe3+水解;
(4)由甲可知,为电解装置,C为阳极,发生4OH--4e-=O2↑+2H2O,Cu为阴极,发生Cu2++2e-=Cu,总反应为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,结合乙可知,转移4mol电子生成2molE,生成1molF,
①C为阳极,电极的电极反应式为:4OH--4e-=O2↑+2H2O,
故答案为:4OH--4e-=O2↑+2H2O;
②由总反应可知,Cu与水的物质的量相同,则E表示反应消耗水的物质的量,由电子与物质的物质的量的关系可知E表示反应生成锌的物质的量,也可以为生成硫酸的物质的量,
故答案为:消耗水的物质的量、生成Zn的物质的量、生成硫酸的物质的量.
点评 本题考查物质的分离和提纯,为高考高频点,侧重考查学生分析、判断、知识运用及基本操作能力,能从整体上分析解答,知道流程图中每个步骤发生的反应、操作方法,题目难度中等.

| A. | 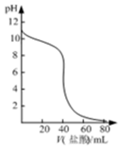 表示常温下盐酸滴加到0.1mol/L某强碱溶液得到的滴定曲线 | |
| B. | 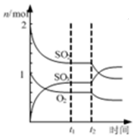 表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| C. | 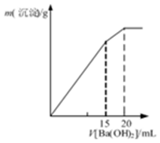 表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mlBa(OH)2溶液时铝离子恰好沉淀完全 | |
| D. | 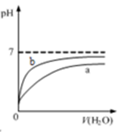 表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
| A. | 18g H2O | B. | 6.02×1023个氮分子 | ||
| C. | 44.8L HCl | D. | 6g氢气 |
①混合物:石炭酸、福尔马林、水玻璃、水银
②化合物:CaCl2、烧碱、苯乙烯、HD
③电解质:明矾、冰醋酸、硫酸钡
④纯净物:干冰、冰水混合物、浓硫酸、水晶
⑤同素异形体:足球烯、石墨、金刚石
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2.
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①③④⑤ | D. | ①②④⑥ |
| A. | 混合气体中二氧化碳与一氧化碳的物质的量各为1:1 | |
| B. | 混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是一氧化碳 | |
| C. | 混合气体的平均相对分子质量为36g•mol-1 | |
| D. | 根据题给条件无法计算混合气体在标准状况下的密度 |
| A. | 2.5mol | B. | 5mol | C. | 25mol | D. | 250mol |
| A. | 在常温常压下,11.2 L N2含有分子数为0.5 NA | |
| B. | 在常温常压下,22.4 L Ne含有分子数为NA | |
| C. | 71 g Cl2所含原子数为2 NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数相同 |
| CH3COOH?CH3COO-+H+ | |||
| 平衡移动方向 | c(H+) | 导电能力 | |
| (1)加水稀释 | |||
| (2)滴加浓盐酸 | |||
| (3)加NaOH | |||
| (4)加醋酸铵 | |||
| (5)升高温度 | |||
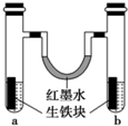 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.