题目内容
10.有A、B、C、D、E依次五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序依次增大.C、D都能分别与A按原子个数比为1:1或2:1形成化合物.CB可与EA2反应生成C2A和气态物质EB4.E的M层电子数是K层电子数的2倍.(1)写出五种元素的名称 B:氧;E:硅.
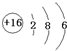
(2)写出电子式 D2A2
 ; EB4
; EB4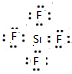 .
.(3)比较EA2与EB4的熔点高低(填化学式)SiO2>SiF4
(4)写出D单质与CuSO4溶液反应的离子方程式2Na+Cu2++2H2O═2Na++Cu(OH)2↓+H2↑.
(5)EB4是由极性键形成的非极性分子(填“极性”或“非极性”,上同).
分析 E的M层电子数是K层电子数的2倍,则E应为Si;C、D都能分别与A按原子个数比为1:1或2:1形成化合物,且A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序依次增大,故C为H,D为Na,A为O;EA2为SiO2,CB可与SiO2反应生成C2A(H2O)和气态物质SiB4,气态SiB4为SiF4,则B为F,据此进行解答.
解答 解:E的M层电子数是K层电子数的2倍,则E应为Si;C、D都能分别与A按原子个数比为1:1或2:1形成化合物,且A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序依次增大,故C为H,D为Na,A为O;EA2为SiO2,CB可与SiO2反应生成C2A(H2O)和气态物质SiB4,气态SiB4为SiF4,则B为F,
(1)根据分析可知B为氟,E为硅,
故答案为:氧;硅;
(2)D2A2为Na2O2,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ;EB4为SiF4,SiF4 属于共价化合物,分子中氟原子与四个硅原子之间形成4对共用电子对,电子式为
;EB4为SiF4,SiF4 属于共价化合物,分子中氟原子与四个硅原子之间形成4对共用电子对,电子式为 ,
,
故答案为: ;
; ;
;
(3)SiO2为原子晶体,SiF4为分子晶体,则熔点:SiO2>SiF4,
故答案为:SiO2>SiF4;
(4)D为Na,Na与硫酸铜反应原理为:钠与水反应生成氢氧化钠和氢气,氢氧化钠与硫酸铜生成氢氧化铜沉淀,单质、沉淀不能拆,故总反应的离子反应方程式为:2Na+Cu2++2H2O═2Na++Cu(OH)2↓+H2↑,
故答案为:2Na+Cu2++2H2O═2Na++Cu(OH)2↓+H2↑;
(5)EB4为SiF4,SiF4是由Si-F极性共价键构成的非极性分子,
故答案为:极性;非极性.
点评 本题考查了位置结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握常见化学用语的书写原则,(4)为易错点,注意那与硫酸铜溶液的反应原理,试题知识点较多,充分考查学生的分析、理解能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 氯仿 | B. | 乙酸 | C. | 苯 | D. | 溴苯 |
| A. | 0.5Q | B. | Q | C. | 2Q | D. | 5Q |
| A. | W g该原子中含有aNA该原子 | |
| B. | 由已知信息可得:NA=$\frac{12}{a}$ | |
| C. | 该原子的摩尔质量是aNA | |
| D. | W g该原子的物质的量一定是$\frac{W}{a{N}_{A}}$mol |
| A. | 摩尔是物质的量的单位 | B. | 摩尔是物质质量的单位 | ||
| C. | 摩尔质量的单位是克 | D. | 摩尔就是物质的量 |
 .
. .
.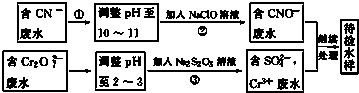

 ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的电子式为
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的电子式为 ,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).
,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).