题目内容
7.固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).

(1)a点正反应速率大于(填大于、等于或小于)逆反应速率.
(2)下列时间段平均反应速率最小的是D.
A.0~1min B.1~3min C.3~8min D.8~11min
(3)求平衡时氢气的转化率和该条件下反应的平衡常数K.(写出计算过程)
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是升高温度,曲线II对应的实验条件改变是增大压强.判断的理由是Ⅱ中反应速率增大,平衡时氢气物质的量减少,说明平衡正移,该反应正方向为气体分子数目减少,因此改变的条件为增大压强.
分析 (1)a点时还没有达到平衡状态,从反应物的物质的量的变化趋势判断反应进行的方向,依次判断正逆反应速率大小;
(2)根据曲线的斜率判断,斜率越大,说明在单位时间内反应物的变化率越大,反应速率越大,也可分别计算不同时间内的反应速率大小来进行比较;
(3)利用三段式进行计算;
(4)从虚线变化判断达到平衡时反应物的转化的物质的量来分析,曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,曲线Ⅲ反应速率增大,转化的氢气的物质的量多,平衡正向移动,应是增大压强.
解答 解:(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率,
故答案为:大于;
(2)分别计算不同时间内的反应速率:0~1min内,v(H2)=$\frac{(8-6)mol}{2L×1min}$=1mol/(L•min);1~3min内,v(H2)=$\frac{(6-3)mol}{2L×(3-1)min}$=0.75mol/(L•min);3~8min内,v(H2)=$\frac{(3-1)mol}{2L×(8-3)min}$=0.1mol/(L•min);8min后达到化学平衡状态,正逆反应速率相等,综合速率为零;所以0~1min内反应速率最大,8~11min反应速率最小,
故答案为:D;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始物质的量/mol 6 8 0 0
物质的量变化/mol 2 6 2 2
平衡物质的量/mol 4 2 2 2
氢气的转化率为:$\frac{n({H}_{2})_{转化}}{n({H}_{2})_{起始}}$=$\frac{6}{8}$=75%,K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$=$\frac{\frac{2mol}{2L}×\frac{2mol}{2L}}{\frac{4mol}{2L}×(\frac{2mol}{2L})^{3}}$=0.5L2•mol-2,
答:平衡时氢气的转化率为75%,该条件下反应的平衡常数为0.5L2•mol-2;
(4)曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故曲线I是升高温度;曲线Ⅲ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强.
故答案为:升高温度;增大压强;Ⅱ中反应速率增大,平衡时氢气物质的量减少,说明平衡正移,该反应正方向为气体分子数目减少,因此改变的条件为增大压强.
点评 此题考查化学反应速率或平衡的图象和热化学反应方程式,考查计算反应速率的大小比较以及反应物转化的多少,注意把握对题目图象的分析.题目较为综合,具有一定难度.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案| A. | 5Cl2+I2+6H2O═10HCl+2HIO3 | |
| B. | 2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)+2H2O | |
| C. | MnO2+4HCI$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | 2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH++Cl2↑+H2↑ |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的化学平衡常数表达式为K=$\frac{{(CO)•({H_2})}}{{(CO)•({H_2}O)}}$,该反应为放热反应(填吸热或放热).
若改变条件使平衡向正反应方向移动,则平衡常数③(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是bc
a.容器中压强不变 b.混合气体中c(CO)不变
c.v逆(H2)=v正(H2O) d.c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应 CO (g)+H2O (g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 900 | a | b | c | d | t |
②若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是b=2a(用含a、b的数学式表示).
| A. | SiO2是由极性键构成的非极性分子 | |
| B. | 若NA表示阿伏伽德罗常数,常温常压下60g SiO2中含有的共价键数目为2NA | |
| C. | 碳和硅同主族,因此CO2和SiO2化学性质相似,物理性质也相似 | |
| D. | SiO2晶体结构中的最小环为6个Si和6个O组成的12元环 |

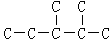 ,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH
,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH 浓度为0.1 mol·L-1 HF
浓度为0.1 mol·L-1 HF 溶液加水不断稀释,下列各
溶液加水不断稀释,下列各 量始终保持增大的是( )
量始终保持增大的是( )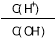 D.
D.