题目内容
 向浓度相等、体积均为50mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100mL.(1)在KOH溶液中通入一定量的SO2气体后,溶液中溶质的组成可能是:
①
③
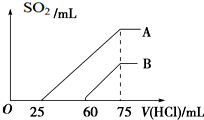
(2)在稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生SO2的体积(标准状况)与所加盐酸的体积关系如图所示.
①A曲线表明,原溶液通入SO2气体后,所得溶质与盐酸反应产生SO2的最大体积是
②B曲线表明,原溶液通入SO2气体后,所得溶液中溶质的化学式为
③原KOH溶液的物质的量浓度为
考点:化学方程式的有关计算
专题:计算题
分析:(1)KOH溶液过量此时溶液中溶质是KOH、K2SO3;两恰好完全反应生成K2SO3;继续过二氧化硫生成K2SO3、KHSO3,二氧化硫与K2SO3恰好完全反应生成KHSO3;
(2)①当生成SO2气体时,发生反应HSO3-+H+=H2O+SO2↑,对于A溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和SO32-+H+=HSO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质;
②逐滴加入0.1mol?L-1 的盐酸,生成SO2气体时,发生反应HSO3-+H+=H2O+SO2↑,对于B溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和SO32-+H+=HSO3-,根消耗盐酸体积相对大小确定所得溶液中的溶质;
③先向氢氧化钾溶液中通入二氧化硫,后向通入二氧化硫的氢氧化钾溶液中滴加盐酸,当二氧化硫气体完全放出时,溶液的溶质是氯化钾,该反应的实质是盐酸和氢氧化钾反应生成氯化钾,根据盐酸的物质的量计算氢氧化钾的物质的量浓度.
(2)①当生成SO2气体时,发生反应HSO3-+H+=H2O+SO2↑,对于A溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和SO32-+H+=HSO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质;
②逐滴加入0.1mol?L-1 的盐酸,生成SO2气体时,发生反应HSO3-+H+=H2O+SO2↑,对于B溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和SO32-+H+=HSO3-,根消耗盐酸体积相对大小确定所得溶液中的溶质;
③先向氢氧化钾溶液中通入二氧化硫,后向通入二氧化硫的氢氧化钾溶液中滴加盐酸,当二氧化硫气体完全放出时,溶液的溶质是氯化钾,该反应的实质是盐酸和氢氧化钾反应生成氯化钾,根据盐酸的物质的量计算氢氧化钾的物质的量浓度.
解答:
解:(1)KOH溶液过量此时溶液中溶质是KOH、K2SO3;两恰好完全反应生成K2SO3;继续过二氧化硫生成K2SO3、KHSO3,二氧化硫与K2SO3恰好完全反应生成KHSO3,故答案为:①KOH、K2SO3;②K2SO3;③K2SO3、KHSO3;④KHSO3;
(2))①当生成SO2气体时,发生反应HSO3-+H+=H2O+SO2↑,对于A溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和SO32-+H+=HSO3-,假设原溶液中只有亚硫酸钾,生成亚硫酸钾需要盐酸的体积和亚硫酸氢钾生成氯化钾需要盐酸的体积相等,实际上需要盐酸的体积25mL小于亚硫酸氢钾生成氯化钾需要盐酸的体积(75-25)mL=50mL,说明原溶液中的溶质是亚硫酸钾和亚硫酸氢钾,又因为25ml:50ml=1:2,所以亚硫酸钾和亚硫酸氢钾的物质的量相等,75ml时生成氯化钾,根据氯守恒,氯化钾的物质的量与盐酸物质的量相等,所以氯化钾的物质的量为0.1mol/L×75ml×10-3L/ml=7.5×10-3mol,所以亚硫酸钾和亚硫酸氢钾的物质的量为2.5×10-3mol,根据硫守恒二氧化硫气体的物质的量为:2.5×10-3mol×2×22.4L/mol=112ml,
故答案为:112;
②逐滴加入0.1mol?L-1 的盐酸,生成SO2气体时,发生反应HSO3-+H+=H2O+SO2↑,对于B溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和SO32-+H+=HSO3-,假设原溶液中只有亚硫酸钾,生成亚硫酸钾需要盐酸的体积和亚硫酸氢钾生成氯化钾需要盐酸的体积相等,实际上需要盐酸的体积60mL大于亚硫酸氢钾生成氯化钾需要盐酸的体积(75-60)mL=15mL,说明原溶液中的溶质是KOH、K2SO3,
故答案为:KOH、K2SO3;
③75ml时生成氯化钾,根据氯守恒,氯化钾的物质的量与盐酸物质的量相等,所以氯化钾的物质的量为0.1mol/L×75ml×10-3L/ml=7.5×10-3mol,钾守恒所以氢氧化钾的物质的量为:7.5×10-3mol,即原KOH溶液的物质的量浓度为
=0.150 mol/L,故答案为:0.150 mol/L.
(2))①当生成SO2气体时,发生反应HSO3-+H+=H2O+SO2↑,对于A溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和SO32-+H+=HSO3-,假设原溶液中只有亚硫酸钾,生成亚硫酸钾需要盐酸的体积和亚硫酸氢钾生成氯化钾需要盐酸的体积相等,实际上需要盐酸的体积25mL小于亚硫酸氢钾生成氯化钾需要盐酸的体积(75-25)mL=50mL,说明原溶液中的溶质是亚硫酸钾和亚硫酸氢钾,又因为25ml:50ml=1:2,所以亚硫酸钾和亚硫酸氢钾的物质的量相等,75ml时生成氯化钾,根据氯守恒,氯化钾的物质的量与盐酸物质的量相等,所以氯化钾的物质的量为0.1mol/L×75ml×10-3L/ml=7.5×10-3mol,所以亚硫酸钾和亚硫酸氢钾的物质的量为2.5×10-3mol,根据硫守恒二氧化硫气体的物质的量为:2.5×10-3mol×2×22.4L/mol=112ml,
故答案为:112;
②逐滴加入0.1mol?L-1 的盐酸,生成SO2气体时,发生反应HSO3-+H+=H2O+SO2↑,对于B溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和SO32-+H+=HSO3-,假设原溶液中只有亚硫酸钾,生成亚硫酸钾需要盐酸的体积和亚硫酸氢钾生成氯化钾需要盐酸的体积相等,实际上需要盐酸的体积60mL大于亚硫酸氢钾生成氯化钾需要盐酸的体积(75-60)mL=15mL,说明原溶液中的溶质是KOH、K2SO3,
故答案为:KOH、K2SO3;
③75ml时生成氯化钾,根据氯守恒,氯化钾的物质的量与盐酸物质的量相等,所以氯化钾的物质的量为0.1mol/L×75ml×10-3L/ml=7.5×10-3mol,钾守恒所以氢氧化钾的物质的量为:7.5×10-3mol,即原KOH溶液的物质的量浓度为
| 7.5×10-3mol |
| 50×10-3L |
点评:本题比较综合,考查了混合物的有关计算关键根据图中盐酸的体积计算出KOH、SO2的物质的量,判断SO2与KOH反应过程,题目难度较大.

练习册系列答案
相关题目
在水溶液中的电离方程式正确的是( )
| A、NaHSO4═Na++HSO4- |
| B、Na2CO3═2Na++CO32- |
| C、MgCl2═Mg2++2Cl2- |
| D、Ba(OH)2═Ba2++(OH)2- |
随着工业的发展,大气中CO2的浓度不断增加,温室效应日益严重.为控制大气中CO2含量的增长,下列措施不切实际的是( )
| A、保护地球上的森林资源 |
| B、增加城市绿地面积 |
| C、禁止使用石油、煤碳等化石燃料 |
| D、限制CO2气体的排放 |
把0.6mol气体X和0.4mol气体Y混合于2L容器中,发生反应:3X(气)+Y(气)?nZ(气)+2W(气),5分钟末已生成0.2molW,若测知以Z浓度变化来表示的平均速率为0.01mol/(L?min),则:上述反应在5分钟末时,已用去的Y占原有量的物质的量分数是( )
| A、20% | B、25% |
| C、33% | D、50% |
 用如图所示实验装置测定某温度下气体摩尔体积,有关叙述错误的是( )
用如图所示实验装置测定某温度下气体摩尔体积,有关叙述错误的是( )| A、将水准管上提,液面高于量气管且不下降,说明装置不漏气 |
| B、可用来测定镁的相对原子质量 |
| C、读取气体体积时水准管的水面高于量气管的水面,可导致测定结果偏高 |
| D、金属镁中含有少量杂质铝,可导致测定结果偏高 |
将1.0体积乙烷和乙烯的混合气体在氧气中充分燃烧,生成2.0体积的CO2和2.4体积的水蒸气(同温同压下测定).则混合物中烷烃和烯烃的体积比为( )
| A、3:1 | B、1:3 |
| C、2:3 | D、3:2 |