题目内容
17.求密度为1.19g/cm3,质量分数为0.37的盐酸的浓度.分析 根据物质的量浓度与溶质质量分数的关系c=$\frac{1000ρω}{M}$计算出该盐酸的物质的量浓度.
解答 解:密度为1.19g/cm3,质量分数为0.37的盐酸的浓度为:c=$\frac{1000×1.19×0.37}{36.5}$mol/L=12.06mol/L,
答:该盐酸的浓度为12.06mol/L.
点评 本题考查了物质的量浓度与溶质质量分数的转化关系,题目难度不大,明确物质的量浓度与溶质质量分数的关系为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
8.下列叙述正确的是( )
| A. | 青铜、黄铜、碳素钢都属于合金 | |
| B. | 棉、麻、丝、有机玻璃都是天然高分子材料 | |
| C. | 糖类、油脂、蛋白质的组成元素完全相同 | |
| D. | 石英玻璃、陶瓷和水泥都是硅酸盐产品 |
5.在一定条件下,反应N2+3H2?2NH3在2L容器中进行,5min内NH3的质量增加了1.7g,则反应速率为( )
| A. | ν(H2)=0.03 mol•L-1•min-1 | B. | ν(NH3)=1.7 g•L-1•min-1 | ||
| C. | ν(N2)=0.02 mol•L-1•min-1 | D. | ν(NH3)=0.01 mol•L-1•min-1 |
12.下列说法正确的是( )
| A. | 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 | |
| B. | CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物 | |
| C. | 酸酐只含两种元素,一种为氧元素,另一种可以为金属或非金属元素,例如CO2、Mn2O7 | |
| D. | 在熔化状态下能导电的化合物为离子化合物 |
2.某铁矿石中含铁的几种氧化物,用足量的CO还原14g该铁矿石,将生成的CO2通入足量的澄清石灰水中,得到沉淀25g,则这种铁矿石的成分不可能是( )
| A. | FeO、Fe2O3 | B. | FeO、Fe3O4 | C. | Fe2O3、Fe3O4 | D. | FeO、Fe2O3、Fe3O4 |
7.乙醚极易挥发、微溶于水、是良好的有机溶剂.乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚.某实验小组用下图装置制取乙醚和乙烯.

有关物质沸点数据
(1)制乙醚:在蒸馏烧瓶中先加入10mL乙醇,慢慢加入10mL浓硫酸,冷却,固定装置.加热到140℃时,打开分液漏斗活塞,继续滴加10mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体.
①Ⅰ和Ⅱ是反应发生装置,应该选择Ⅰ(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连.
②乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是防止乙醇挥发.
③Ⅲ中水冷凝管的进水口是b(选答“a”或“b”).冰盐水的作用是凝液化乙醚.
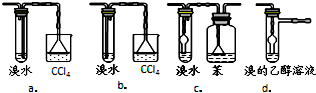
④有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险.该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)c、d.
⑤反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色.写出实验过程中有气体生成的化学方程式(写两个方程式)CH3CH2OH+6H2SO4$\stackrel{△}{→}$2CO2↑+6SO2↑+↑+2H2O;C+2H2SO4$\stackrel{△}{→}$CO2↑+2SO2↑+2H2O、CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O、CH3CH2OH+2H2SO4$\stackrel{△}{→}$2C+2SO2↑+5H2O(其中两个).
⑥实验中收集到的乙醚产品中可能含有多种杂质.某同学设计了以下提纯方案:

(2)分液步骤除去产品中的酸性杂质,则X可以是NaOH.
(3)蒸馏操作可除去的杂质是乙醇(CH3CH2OH).

有关物质沸点数据
| 物质 | 沸点 |
| 乙醚 | 34.6℃ |
| 乙醇 | 78.2℃ |
①Ⅰ和Ⅱ是反应发生装置,应该选择Ⅰ(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连.
②乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是防止乙醇挥发.
③Ⅲ中水冷凝管的进水口是b(选答“a”或“b”).冰盐水的作用是凝液化乙醚.
④有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险.该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)c、d.

⑤反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色.写出实验过程中有气体生成的化学方程式(写两个方程式)CH3CH2OH+6H2SO4$\stackrel{△}{→}$2CO2↑+6SO2↑+↑+2H2O;C+2H2SO4$\stackrel{△}{→}$CO2↑+2SO2↑+2H2O、CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O、CH3CH2OH+2H2SO4$\stackrel{△}{→}$2C+2SO2↑+5H2O(其中两个).
⑥实验中收集到的乙醚产品中可能含有多种杂质.某同学设计了以下提纯方案:

(2)分液步骤除去产品中的酸性杂质,则X可以是NaOH.
(3)蒸馏操作可除去的杂质是乙醇(CH3CH2OH).
4.有机化合物种类繁多的主要原因是( )
| A. | 有机化合物主要来自自然界众多的有机体 | |
| B. | 有机物分子中的碳原子成键方式具有多样性 | |
| C. | 可以人工合成 | |
| D. | 可以由无机物进行转化 |
5.氢化氨(NH4H)与氯化铵(NH4Cl)结构相似.但NH4H与水反应有氢气生成,下列叙述正确的是( )
| A. | NH4H与水反应时,NH4H是还原剂 | B. | NH4H溶于水时,溶液显酸性 | ||
| C. | H-的离子半径小于Li+的离子半径 | D. | NH4H中只有离子键没有共价键 |