题目内容
14.偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是N2O4.
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)?2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为吸热(填“吸热”或“放热”)反应.
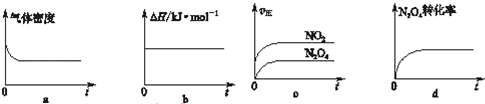
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中,下列示意图如图正确且能说明反应达到平衡状态的是ad.
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将逆向(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1.(NH3•H2O的电离平衡常数取Kb=2×10-5mol•L-1)
分析 (1)在氧化还原反应中化合价降低的反应物是氧化剂;
(2)升高温度,平衡向吸热反应方向移动;
(3)根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断;
(4)依据铵根离子水解分析回答;依据同粒子效应,一水合氨对铵根离子水解起到抑制作用;依据一水合氨的电离平衡常数计算得到氨水浓度.
解答 解:(1)反应(Ⅰ)中,N2O4(l)中N元素得电子化合价降低,N2O4(l)是氧化剂,(CH3)2NNH2(l)中碳元素化合价升高,是还原剂,
故答案为:N2O4;
(2)升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应即△H>0,
故答案为:吸热;
(3)a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故答案为:ad;
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,是因为铵根离子水解;反应的离子方程式为:NH4++H2O?NH3•H2O+H+;加入氨水溶液抑制铵根离子水解,平衡逆向进行;将a mol NH4NO3溶于水,向该溶液滴加b L 氨水后溶液呈中性,依据电荷守恒计算可知,溶液中氢氧根离子浓度=10-7mol/L,c(NH4+)=c(NO3-);NH3•H2O的电离平衡常数取Kb=2×10-5mol•L-1,设混合后溶液体积为1L,(NH4+)=c(NO3-)=amol/L;根据一水合氨电离平衡得到:NH3•H2O?NH4++OH-,平衡常数K=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{amol/L×1{0}^{-7}mol/L}{bL×c(N{H}_{3}•{H}_{2}O)mol/L}$=2×10-5mol•L-1,计算得到c(NH3•H2O)=$\frac{a}{200b}$mol/L,
故答案为:NH4++H2O?NH3•H2O+H+;逆向;$\frac{a}{200b}$.
点评 本题考查了氧化还原反应的概念判断,化学平衡的影响因素分析,平衡标志的判断理解,平衡常数的影响因素和计算应用,化学反应速率的计算分析,弱电解质溶液中的电离平衡的计算应用,综合性较大,难度中等.


| A. | 该物质的分子式是C8H10ClO | |
| B. | 1 mol该物质最多可以与2 mol NaOH反应 | |
| C. | 1 mol该物质可以与2 mol液溴发生取代反应 | |
| D. | 该物质可以发生加成、取代、消去、氧化等反应 |
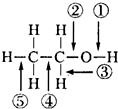 乙醇分子结构中各化学键如图所示.关于乙醇在各种反应中断裂键的说法不正确的是( )
乙醇分子结构中各化学键如图所示.关于乙醇在各种反应中断裂键的说法不正确的是( )| A. | 和金属钠反应时键①断裂 | |
| B. | 和浓H 2SO4共热到170℃时断键②和⑤ | |
| C. | 在银催化条件下与O2反应时断键①和③ | |
| D. | 和浓H 2SO4共热到140℃时断键②,其他键不变化 |
| A. | 氯气 | B. | 二气体氧化氮 | C. | 硫化氢 | D. | 二氧化碳 |
 ,关于它的说法正确的是( )
,关于它的说法正确的是( )| A. | 1mol咖啡酸能和1mol NaOH溶液反应 | |
| B. | 1 mol咖啡酸与足量Na反应放出1.5molH2 | |
| C. | 1mol咖啡酸能和3molBr2发生反应 | |
| D. | 咖啡酸不能和FeCl3溶液发生显色反应 |
| A. | Pt | B. | Cu | C. | A1 | D. | Ag |
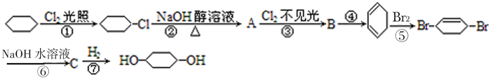
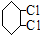 C:
C:
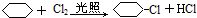 ;④:
;④: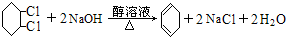 .
.