题目内容
6.如何除去氯化亚铁中的氯化铁,写出其化学方程式Fe+2FeCl3═3FeCl2,其反应的离子方程式是Fe+2Fe3+═3Fe2+.分析 除去氯化亚铁中的氯化铁,可向混合物中加入过量铁粉,将杂质氯化铁转化成氯化亚铁,据此写出反应的化学方程式、离子方程式.
解答 解:氯化亚铁中混有氯化铁,可加入过量铁粉将氯化铁转化成氯化亚铁,反应的化学方程式为:Fe+2FeCl3═3FeCl2,离子方程式为:Fe+2Fe3+═3Fe2+,
故答案为:Fe+2FeCl3═3FeCl2;Fe+2Fe3+═3Fe2+.
点评 本题考查了物质的分离与提纯、离子方程式、化学方程式的书写,题目难度不大,明确常见物质性质为解答关键,注意掌握离子方程式、化学方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
20.下列说法不正确的是( )
| A. | 常温下pH=11的氨水中,由水电离产生的c(OH-)=10-11mol/L | |
| B. | pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后的溶液中,c(H+)>c(OH-) | |
| C. | NaHCO3溶液中,存在c(H+)=c(OH-)+c(${CO}_{3}^{2-}$) | |
| D. | 0.1 mol/L的NH4Cl溶液中:c(Cl-)>c(${NH}_{4}^{+}$)>c(H+)>c(OH-) |
1.下列说法正确的是( )
| A. | 摩尔是物质的质量单位 | B. | H2的摩尔质量是2g | ||
| C. | 1molH2O的质量是18g | D. | 1molO2的体积是22.4L |
11.在一定条件下,一定量的A和B气体发生如下可逆反应:A(g)+3B(g)?3C(g),只有反应到达平衡时才具有的性质是( )
| A. | 各物质的浓度之比为1:3:3 | |
| B. | 混合物各物质的浓度相等 | |
| C. | A、B、C三种物质的浓度不随时间变化而变化 | |
| D. | ν(A)、ν(B)、ν(C) 之比为1:3:3 |
18.下列叙述不正确的是( )
| A. | 在海轮外壳上镶锌块,可减缓船体的腐蚀 | |
| B. | 钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气最终转化为铁锈 | |
| C. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| D. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
16.分类是学习和研究化学的一种重要方法,下列分类合理的是( )
| A. | KNO3和K2O都属于盐 | B. | KOH和Na2CO3都属于碱 | ||
| C. | H2SO3和HNO3都属于酸 | D. | CaO和Na2SO4都属于氧化物 |
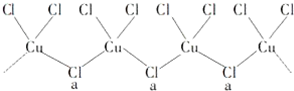



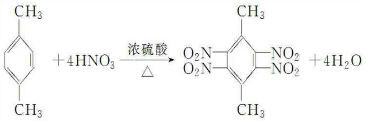 .
.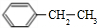 、
、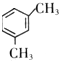 .
.