��Ŀ����
16��ij��Ӧ��ϵ�У��з�Ӧ��������ﹲ�������ʣ�HCl��Ũ����KClO3��KCl��ClO2��Cl2��H2O����֪�÷�Ӧ�У�KClO3������һ�����̣�KClO3��ClO2��ClO2�ǻ���ɫ�ױ������壮��1��д������ƽ�������̵Ļ�ѧ����ʽ�����������ת�Ƶķ������Ŀ��
 ��
����2���÷�Ӧ�У����������˻�ԭ�ԡ������ʣ���������KClO3����Ӧ��������0.6mol���壬��ת�Ƶ��ӵ����ʵ���Ϊ0.4mol��
��3��ClO2��һ�ֹ����͵�����������ҵ��ClO2����NaClO3��Na2SO3��Һ��ϣ�����H2SO4��Ӧ�Ƶã������Ϸ�Ӧ�У�NaClO3��Na2SO3�����ʵ���֮��Ϊ2��1��
���� ��1��KClO3����Ԫ�ػ��ϼ���+5�۽���ΪClO2��+4�ۣ����ϼ۽���1�ۣ�HCl����Ԫ�ػ��ϼ���-1������ΪCl2��0�ۣ����ϼ�����2�ۣ����ϼ�������С������Ϊ2����ClO2ϵ��Ϊ2��Cl2ϵ��Ϊ1���ٽ��ԭ���غ㣬��ƽ�����ʵ�ϵ����
��2������KCl������������ԣ�������������HCl�Ļ�ԭ�ԣ��������ClԪ�صĻ��ϼ۽��ͣ�������0.6mol���壬�ɷ�Ӧ��֪����ֻ��0.2mol���Դ˼��㣻
��3��ClO2����NaClO3��Na2SO3��Һ��ϣ�����H2SO4��Ӧ�Ƶã���ClԪ�صĻ��ϼ���+5�۽���Ϊ+4�ۣ���SԪ�صĻ��ϼ���+4������Ϊ+6�ۣ���ϵ����غ���㣮
��� �⣺��1��KClO3����Ԫ�ػ��ϼ���+5�۽���ΪClO2��+4�ۣ����ϼ۽���1�ۣ�HCl����Ԫ�ػ��ϼ���-1������ΪCl2��0�ۣ����ϼ�����2�ۣ����ϼ�������С������Ϊ2����ClO2ϵ��Ϊ2��Cl2ϵ��Ϊ1������KClO3ϵ��Ϊ2��KClϵ��Ϊ2��HClϵ��Ϊ4�����ԭ���غ���ƽ����ʽ���䷴Ӧ����ʽΪ2KClO3+4HCl��Ũ��=2KCl+2ClO2��+Cl2��+2H2O������ת�Ƶķ������ĿΪ
�ʴ�Ϊ�� ��
��
��2������KCl������������ԣ�������������HCl�Ļ�ԭ�ԣ���÷�Ӧ��������Ļ�ԭ�ԡ����ԣ��������ClԪ�صĻ��ϼ۽��ͣ���������ΪKClO3��������0.6mol���壬�ɷ�Ӧ��֪����ֻ��0.2mol��ת�Ƶ���Ϊ0.2mol��2����1-0��=0.4mol��
�ʴ�Ϊ����ԭ�ԣ��KClO3��0.4��
��3��ClO2����NaClO3��Na2SO3��Һ��ϣ�����H2SO4��Ӧ�Ƶã���ClԪ�صĻ��ϼ���+5�۽���Ϊ+4�ۣ���SԪ�صĻ��ϼ���+4������Ϊ+6�ۣ��ɵ����غ��֪��NaClO3��Na2SO3�����ʵ���֮��Ϊ$\frac{��6-4��}{��5-4��}$=2��1���ʴ�Ϊ��2��1��
���� ���⿼��������ԭ��Ӧ�ļ��㣬Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬����������ԭ��Ӧ��ת�Ƶĵ������ļ��㣬��ȷ���ϼ۵ı仯�Ƿ����Ĺؼ���ע������غ��Ӧ�ã���Ŀ�Ѷ��еȣ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | 0.02mol/��L•s�� | B�� | 1.8mol��L•s�� | C�� | 1.2mol/��L•s�� | D�� | 0.18mol/��L•s�� |
| A�� | y=x | B�� | y=1-x | C�� | y=x-0.5 | D�� | y=1-x��0.5 |
| A�� | 100mL1mol/L�������к�HCl������Ϊ0.1NA | |
| B�� | 7.8gNa2O2��Na2S�Ļ��������������ĿΪ0.2NA | |
| C�� | ��״���£�2.24L SO3�к�����ԭ����ĿΪ0.3NA | |
| D�� | 2gD216O�к����ӡ����ӡ�������Ŀ��ΪNA |
| A�� | ��Ȼ��������ϩ�������о��������ֹ����� | |
| B�� | ������Һ�������ø�ƿ����Һ�� | |
| C�� | ��ҵ�ƾ���Ũ��ͨ��Ϊ95% | |
| D�� | ��ij��Һ����CCl4����CCl4���ԳȺ�ɫ��֤��ԭ��Һ�д���Br2 |

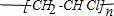 ��
�� ��b��
��b��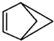 ����ش��������⣺
����ش��������⣺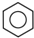 �ṹ��������Щ���治ͬD������ĸ���ţ���
�ṹ��������Щ���治ͬD������ĸ���ţ���