题目内容
用双线桥标出下列反应中的电子转移的方向及数目并指出氧化剂和还原产物
(1)Fe2O3+3CO=2Fe+3CO2氧化剂: 还原产物:
(2)MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑ 氧化剂: 还原产物: .
(1)Fe2O3+3CO=2Fe+3CO2氧化剂:
(2)MnO2+4HCl(浓)
| ||
考点:氧化还原反应
专题:氧化还原反应专题
分析:化合价升高元素失电子,所在反应物是还原剂,对应产物是氧化产物,化合价降低元素得到电子,所在反应物是氧化剂,对应产物是还原产物,化合价升高数=化合价降低数=转移电子数.
(1)反应Fe2O3+3CO═2Fe+3CO2中,Fe元素化合价由+3价降低到0价,被还原,Fe2O3为氧化剂,C元素化合价由+2价升高到+4价,被氧化,CO为还原剂,根据化合价的变化判断电子转移的方向和数目;
(2)MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑ 中,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
(1)反应Fe2O3+3CO═2Fe+3CO2中,Fe元素化合价由+3价降低到0价,被还原,Fe2O3为氧化剂,C元素化合价由+2价升高到+4价,被氧化,CO为还原剂,根据化合价的变化判断电子转移的方向和数目;
(2)MnO2+4HCl(浓)
| ||
解答:
解:(1)Fe元素的化合价由+3降低为0,C元素的化合价由+2升高为+4价,则Fe2O3为氧化剂,Fe元素被还原,对应Fe为还原产物,
该反应中3molCO参加反应,转移6mol电子,则双线桥表示该反应电子转移的方向和数目为 ,
,
故答案为:Fe2O3;Fe; ;
;
(2)化合价升高的Cl元素失2mol电子,化合价降低的Mn元素得到2mol电子,电子转移情况为: ,化合价升高元素是Cl,所在反应物HCl是还原剂,对应产物Cl2是氧化产物,化合价降低的是Mn元素,反应物MnO2是氧化剂,对应的MnCl2为还原产物,
,化合价升高元素是Cl,所在反应物HCl是还原剂,对应产物Cl2是氧化产物,化合价降低的是Mn元素,反应物MnO2是氧化剂,对应的MnCl2为还原产物,
故答案为:MnO2;MnCl2; .
.
该反应中3molCO参加反应,转移6mol电子,则双线桥表示该反应电子转移的方向和数目为
 ,
,故答案为:Fe2O3;Fe;
 ;
;(2)化合价升高的Cl元素失2mol电子,化合价降低的Mn元素得到2mol电子,电子转移情况为:
 ,化合价升高元素是Cl,所在反应物HCl是还原剂,对应产物Cl2是氧化产物,化合价降低的是Mn元素,反应物MnO2是氧化剂,对应的MnCl2为还原产物,
,化合价升高元素是Cl,所在反应物HCl是还原剂,对应产物Cl2是氧化产物,化合价降低的是Mn元素,反应物MnO2是氧化剂,对应的MnCl2为还原产物,故答案为:MnO2;MnCl2;
 .
.
点评:本题考查氧化还原反应,为高频考点,把握电子守恒、原子守恒及反应中元素化合价变化为解答的关键,侧重基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将10mol A和5mol B放入10L真空容器内,某温度下发生反应:3A(g)+B(g)?2C(g),在最初的2s内,消耗A的平均速率为0.06mol?L-1?s-1,则在2s时,容器中C的物质的量是( )
| A、1.2mol |
| B、0.8mol |
| C、0.4mol |
| D、8mol |
在2升的密闭容器中,发生以下反应:2A(g)+B(g)?2C(g)+D(g).若最初加入的A和B都是3mol,在前10秒钟A的平均反应速率为0.12mol/(L?s),则10秒钟时,容器中B的物质的量的浓度是( )
| A、1.8mol/L |
| B、1.0mol/L |
| C、0.9mol/L |
| D、2.8mol/L |
如果1g水中含有n个氢原子,则阿伏加德罗常数是( )mol-1.
A、
| ||
| B、9n | ||
| C、2n | ||
| D、n |
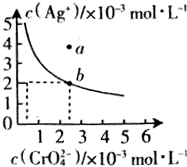 某温度时,向AgNO3溶液中加入K2CrO4溶液会生成Ag2CrO4沉淀,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.
某温度时,向AgNO3溶液中加入K2CrO4溶液会生成Ag2CrO4沉淀,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.