题目内容
8.下列说法不正确的是( )| A. | F2、Cl2、Br2、I2的相对分子质量逐渐增大,熔沸点逐渐升高 | |
| B. | C2Cl6分子中各原子均满足8电子稳定结构 | |
| C. | Cl-、S2-、Ca2+、K+的半径逐渐减小 | |
| D. | 质量数相等的不同核素,一定属于不同种元素 |
分析 A.组成和结构相似的分子,熔点随相对分子质量增大而升高;
B.每个碳原子连接3个氯原子,且两个碳原子相连,所以都满足8电子结构;
C.离子的电子层相同时,核电荷数越大,离子半径越小;
D.同种元素具有相同的质子数,质量数=质子数+中子数,若不同核素的质量数相等,则一定不会是同一种元素.
解答 解:A.F2、Cl2、Br2、I2是组成和结构相似的分子,熔点随相对分子质量增大而升高,故A正确;
B.C2Cl6分子中,每个C与3个Cl原子形成3个共用电子对,且两个C原子之间形成了1个C-C键,所以C、Cl原子的最外层都达到了8电子稳定结构,故B正确;
C.Cl-、S2-、Ca2+、K+都含有3个电子层,离子的核电荷数越大,离子半径越小,则离子半径从大到小的顺序为:Cl-、S2-、K+、Ca2+,故C错误;
D.质量数相等的不同核素,若是同一种元素,则具有相同的质子数,而质量数=质子数+中子数,所以该两种核素具有相同的中子数,即:这两种核素具有相同的中子数和中子数,为同一种核素,所以质量数相等的不同核素,一定属于不同种核素,故D正确;
故选C.
点评 本题考查了原子核外电子排布、离子半径大小比较、晶体沸点比较等知识,题目难度中等,注意掌握离子半径大小的判断方法及常见晶体的性质,明确原子结构及核外电子排布原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
18.研究证明高铁酸钠(Na2FeO4)是一种“绿色环保高效”消毒剂,比目前国内外广泛使用的含氯饮用水消毒剂性能更为优良.请你推断高铁酸钠(Na2FeO4)中铁元素的化合价( )
| A. | +2 | B. | +3 | C. | +5 | D. | +6 |
19.下列各反应的离子方程式中,有错误的是( )
| A. | 氢氧化铝与盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 碘化钾溶液中滴入溴水:2I-+Br2═I2+2Br- | |
| D. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+3OH-═AlO2-+3H2O |
16.下列反应中,非金属单质未表现出氧化性的是( )
| A. | 氯气被强碱溶液吸收 | B. | 铁在氯气中燃烧 | ||
| C. | 硫在氢气中反应生成硫化氢 | D. | 硫在空气中燃烧 |
13.下列反应中,能说明氯的氧化性比硫强的反应是( )
| A. | CuCl2+H2S═CuS↓+2HCl | B. | 2HCl+Na2S═2NaCl+H2S | ||
| C. | Cl2+H2S═2HCl+S | D. | 3Cl2+6FeSO4═2Fe2(SO4)3+2FeCl3 |
11.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
实验流程如下:
请回答下列问题:
(1)第②步中所加CaCO3还发生了其它反应,写出其中一个主要反应的方程式CaCO3+2HBr=CaBr2+CO2↑+H2O;
充分反应后CaCO3固体需有剩余,目的是提高葡萄糖酸的转化率,便于后续分离;
(2)第③步需趁热过滤,原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;
(3)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(4)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用.工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:
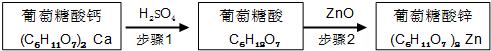
步骤1:充分反应后,过滤除去CaSO4沉淀.
步骤2:将葡萄糖酸溶液与ZnO混合.
(5)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解.
(6)下列物质可替代ZnO的是be(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4 e.ZnCO3.
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

请回答下列问题:
(1)第②步中所加CaCO3还发生了其它反应,写出其中一个主要反应的方程式CaCO3+2HBr=CaBr2+CO2↑+H2O;
充分反应后CaCO3固体需有剩余,目的是提高葡萄糖酸的转化率,便于后续分离;
(2)第③步需趁热过滤,原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;
(3)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(4)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用.工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:

步骤1:充分反应后,过滤除去CaSO4沉淀.
步骤2:将葡萄糖酸溶液与ZnO混合.
(5)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解.
(6)下列物质可替代ZnO的是be(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4 e.ZnCO3.
