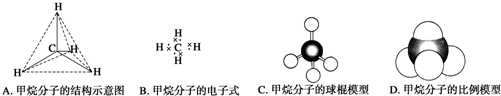
题目内容
16.已知:A、B、C、D、E五种金属可按如下方式组成原电池:①A与B和CuSO4溶液组成原电池后,B极上附一层红色的铜.
②B、C和CuSO4溶液组成原电池时,B的质量逐渐减轻.
③A,D与CuSO4溶液组成原电池后,电子由D极经导线流向A极
④D、E与稀酸组成原电池后,在D极有大量气泡产生.
则五种金属的活动性由强到弱的顺序是E>D>A>B>C.
分析 原电池中,电子由负极流向正极,活泼金属作负极,负极上失去电子,正极上有气体或金属析出,负极的金属活泼性大于正极,以此来比较金属的活泼性.
解答 解:①A与B和CuSO4溶液组成原电池后,B极上附一层红色的铜,则B为正极,活泼性:A>B;
②B、C和CuSO4溶液组成原电池时,B的质量逐渐减轻,B为负极,A为正极,活泼性:B>C;
③A,D与CuSO4溶液组成原电池后,电子由D极经导线流向A极,则D失电子为负极,A为正极,活泼性:D>A;
④D、E与稀酸组成原电池后,在D极有大量气泡产生,则D为正极,E为负极,活泼性:E>D,
所以金属活泼性:E>D>A>B>C.
故答案为:E>D>A>B>C.
点评 本题考查原电池原理及金属活泼性的比较,明确活泼金属作负极,失去电子及电子的流向即可解答,题目较简单,侧重于基础知识的考查.

练习册系列答案
相关题目
6.某澄清溶液中存在大量的Ba2+、NH4+、Cl-,该溶液中还可能大量存在的离子是( )
| A. | Fe3+ | B. | CO32- | C. | Ag+ | D. | OH- |
4.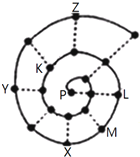 如图所示为“蜗牛”状的元素周期表,其中每个“•”代表一种元素,P点代表氢元素.下列说法正确的是( )
如图所示为“蜗牛”状的元素周期表,其中每个“•”代表一种元素,P点代表氢元素.下列说法正确的是( )
 如图所示为“蜗牛”状的元素周期表,其中每个“•”代表一种元素,P点代表氢元素.下列说法正确的是( )
如图所示为“蜗牛”状的元素周期表,其中每个“•”代表一种元素,P点代表氢元素.下列说法正确的是( )| A. | Y元素对应的氢化物比Z元素对应的氢化物更稳定 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | M、K元素的离子半径大小顺序是M2+>K2- | |
| D. | 由K、L两种元素组成的化合物中不可能含有共价键 |
11.铁及碳的化合物在社会生产、生活中有着广泛的应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+4C(s)?3Fe(s)+4CO(g)△H=+646.0kJ•mol-1
②C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)△H=-44.0kJ/mol.
(2)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
①从表中数据可推断,该反应是吸热(填“放热”或“吸热”)反应.
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是BD(填字母).
A.c(CO2)=c(CO) B.v正(CO2)=v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+CO2(g)?CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:
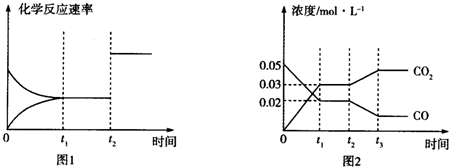
①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=0.006mol•L-1•s-1.
②图1中t2时刻改变的条件是加入催化剂或增大压强(任写两种,下同);图2中t2时刻改变的条件是降低温度或增大水蒸气浓度或减小氢气浓度.
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和CO2,熔融碳酸钠作为电解质,工作时负极反应式为CO+CO32--2e-=2CO2;若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为6.72L
(标准状况下).
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+4C(s)?3Fe(s)+4CO(g)△H=+646.0kJ•mol-1
②C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)△H=-44.0kJ/mol.
(2)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
| 温度/K | 973 | 1173 | 1373 | 1573 |
| K | 1.47 | 2.15 | 3.36 | 8.92 |
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是BD(填字母).
A.c(CO2)=c(CO) B.v正(CO2)=v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+CO2(g)?CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:

①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=0.006mol•L-1•s-1.
②图1中t2时刻改变的条件是加入催化剂或增大压强(任写两种,下同);图2中t2时刻改变的条件是降低温度或增大水蒸气浓度或减小氢气浓度.
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和CO2,熔融碳酸钠作为电解质,工作时负极反应式为CO+CO32--2e-=2CO2;若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为6.72L
(标准状况下).
1.下列说法不正确的是( )
| A. | 用分液漏斗分液时,先打开旋塞,待下层液体完全分出后,关闭旋塞,再从上口倒出上层液体 | |
| B. | 在油脂皂化反应实验中,用玻璃棒蘸取反应液滴入热水中,若无油滴浮于液面上,说明皂化反应已经完全 | |
| C. | 在中和热测定实验中,盐酸和NaOH溶液的总质量m g,反应前后体系温度变化△t℃,反应液的比热容为c J•g-1•℃-1,则生成1mol水放出的热量为cm△t×10-3kJ | |
| D. | 同一温度下,可通过观察出现浑浊的快慢来探究浓度对Na2S2O3与稀硫酸反应速率的影响 |
17.在水溶液中进行反应3KSCN+FeCl3?Fe(SCN)3+3KCl,当达到平衡时,下列说法错误的是( )
| A. | 加水稀释,平衡左移,溶液颜色变浅 | |
| B. | 加入一定量的NaOH溶液,有红褐色沉淀产生,溶液颜色变浅 | |
| C. | 加入一定量的铁粉,充分振荡后,溶液颜色变浅 | |
| D. | 加入少量的KCl固体,平衡左移,溶液颜色变浅 |
18.短周期的四种非金属元素m、n、p、q原子序数依次增大,n与q为同主族元素,m和p原子最外层电子数之和等于n和q原子最外层电子数之和,p的单质在常温下能与水剧烈反应.下列说法一定正确的是( )
| A. | 原子半径:m>n | B. | 氢化物的稳定性:n>p | ||
| C. | q的最高价氧化物的水化物为强酸 | D. | n在自然界中能以游离态存在 |