题目内容
13.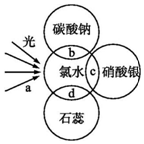 氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)
氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)(1)能证明氯水具有漂白性的是d(填“a”“b”“c”或“d”).
(2)c过程中的现象是有白色沉淀生成,b过程中的化学方程式为Na2CO3+2HCl=NaCl+H2O+CO2↑.
(3)久置的氯水变为稀盐酸,用化学反应方程式表示为2HClO=2HCl+O2↑.
分析 氯水中含有盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,d过程所观察到的现象是先变红色,后褪色;b过程是氯水中的盐酸和碳酸钠反应生成二氧化碳气体证明了氯水中存在酸,c过程的反应是氯水中的盐酸和硝酸银反应得到氯化银沉淀,由此分析解答.
解答 解:(1)氯水中含有盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,d过程所观察到的现象是先变红色,后褪色,故答案为:d;
(2)c过程的反应是氯水中的盐酸和硝酸银反应得到氯化银沉淀,过程是氯水中的盐酸和碳酸钠反应生成二氧化碳气体,反应的化学方程式为:Na2CO3+2HCl=NaCl+H2O+CO2↑
;故答案为:有白色沉淀生成;Na2CO3+2HCl=NaCl+H2O+CO2↑;
(3)久置的氯水变为稀盐酸,反应的化学方程式为:2HClO=2HCl+O2↑,故答案为:稀盐酸;2HClO=2HCl+O2↑.
点评 本题考查氯气的性质,题目难度不大,注意氯水的成分和性质,化学方程式书写,注重基础知识的积累.

练习册系列答案
相关题目
4.已知H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)↓+2H2O(l)△H=-1 584.2kJ•mol-1;HCl(aq)与NaOH(aq)反应的中和热△H=-55.6kJ•mol-1.则生成SO42-(aq)+Ba2+(aq)=BaSO4(s)的反应热等于( )
| A. | -1 528.6 kJ•mol-1 | B. | -1 473 kJ•mol-1 | ||
| C. | +1 473 kJ•mol-1 | D. | +1 528.6 kJ•mol-1 |
8.0.5L Cl-为3mol/L的 FeCl3溶液的物质的量浓度为( )
| A. | 3 mol/L | B. | 1.5 mol/L | C. | 1 mol/L | D. | 0.5 mol/L |
18.下列说法没有科学性错误的是( )
| A. | “白雪牌”漂白粉可令所有有色物质黯然失“色”,没有最白,只有更白 | |
| B. | CO有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收CO,防止煤气中毒 | |
| C. | 氯化钙具有吸水性和潮解性,夏日里用它的水溶液喷洒柏油路,可有效地保护路面 | |
| D. | 氯元素有毒,禁止放入口中 |
5.只能表示一个化学反应的离子方程式是( )
| A. | Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| B. | CO32-+2H+=H2O+CO2↑ | |
| C. | 2Br-+Cl2=2Cl-+Br2 | |
| D. | SO2+Cl2+2H2O=4H++2Cl-+SO42- |
 .
. .
.