题目内容
8.0.5L Cl-为3mol/L的 FeCl3溶液的物质的量浓度为( )| A. | 3 mol/L | B. | 1.5 mol/L | C. | 1 mol/L | D. | 0.5 mol/L |
分析 设FeCl3溶液的物质的量浓度为x,则Cl-浓度为3x=3mol/L,以此来解答.
解答 解:设FeCl3溶液的物质的量浓度为x,则Cl-浓度为3x=3mol/L,解得x=1mol/L,
故选C.
点评 本题考查物质的量浓度的计算,为高频考点,把握溶质浓度与离子浓度的关系为解答的关键,侧重分析与计算能力的考查,注意离子浓度与溶液体积无关,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
3.关于NaHCO3和Na2CO3的性质判断正确的是( )
| A. | 常温下溶解度:NaHCO3>Na2CO3 | |
| B. | 常温下,相同物质的量浓度溶液的碱性:NaHCO3>Na2CO3 | |
| C. | 热稳定性:NaHCO3<Na2CO3 | |
| D. | 与同浓度、同体积的盐酸反应生成气体的快慢:NaHCO3<Na2CO3 |
4.某新型燃料电池以乙烯为原料制备乙醛并获得电能,工作原理如图所示.下列有关说法正确的是( )

| A. | a电极为正电极 | |
| B. | 放电时,若有2mol电子转移,则理论上需要消耗28g乙烯 | |
| C. | a极的电极反应式为CH2═CH2+2OH--2e-═CH3CHO+H2O | |
| D. | 电子移动方向:a电极→磷酸溶液→b电极 |
16.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2LSO3所含的氧原子数为1.5NA | |
| B. | 常温常压下,7.8gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA | |
| C. | 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA | |
| D. | 500ml 1mol/L醋酸溶液中含氧原子数为NA |
3.与苯互为同系物的是( )
| A. |  | B. |  | C. |  | D. |  |
20.在密闭容器中的一定量的混合气体发生反应:平衡xA(g)+yB(g)?zC(g)平衡时测得C的浓度为1mol•L-1,保持温度不变,将容器的容积扩大到原来的1倍,再达到平衡时,测得C的浓度为0.6mol•L-1,下列有关判断正确的是( )
| A. | x+y>z | B. | 平衡向逆反应方向移动 | ||
| C. | B的转化率降低 | D. | A的体积分数减小 |
17.下列说法正确的是( )
| A. | 油脂、糖类和蛋白质均为高分子化合物 | |
| B. | 植物秸秆的主要成分是纤维素,纤维素在催化剂作用下经水解可得葡萄糖,葡萄糖在酒化酶的作用下能转化为酒精 | |
| C. | 往含硫酸的淀粉水解液中加入银氨溶液,水浴加热后无银镜产生,说明淀粉未水解 | |
| D. | 向鸡蛋清的溶液中加入甲醛溶液,可观察到蛋白质发生凝聚,再加入蒸馏水,振荡后蛋白质又发生溶解 |
18.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 漂白粉溶液中:H+、NH4+、SO42-、Br- | |
| B. | 滴加苯酚显紫色的溶液:CO32-、Na+、NO3-、SO42- | |
| C. | 在c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| D. | 能溶解氢氧化铝的溶液中:Na+、K+、Cl-、S2- |
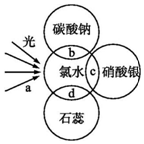 氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)
氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)