题目内容
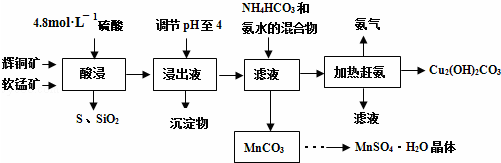
15.氯化亚铜广泛用作有机合成催化剂,用低品位铜矿(含CuS、Cu2S、CuO以及杂质FeO、Fe2O3)制备氯化亚铜的工艺如下:
回答下列问题:
(1)步骤①浸取时,发生的反应之一为CuS被MnO2氧化为S,MnO2被还原为MnSO4,该反应的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S+2H2O
(2)滤渣2的成分为Fe(OH)3(填化学式,下同).
(3)步骤⑤发生反应的化学方程式为Cu(NH3)4CO3$\frac{\underline{\;\;△\;\;}}{\;}$CuO+4NH3↑+CO2↑;热解生成的CO2的电子式为
 .
.(4)制取Na[CuCl2]时,发生反应的化学方程式为Cu+CuO+2NaCl+2HCl=2 Na[CuCl2]+H2O,滤液4中溶质的成分为NaCl或NaCl和HCl(填化学式).
(5)步骤⑧中醇洗的目的是除去表面的酸并使产品快速干燥.
分析 铜矿(含CuS、Cu2S、CuO以及杂质FeO、Fe2O3)中加入稀硫酸、二氧化锰,CuS和二氧化锰、稀硫酸发生氧化还原反应,发生的离子反应方程式为CuS+MnO2+4H+=Cu2++Mn2++S+2H2O,Cu2S、CuO以及杂质FeO、Fe2O3分别与稀硫酸反应离子方程式为Cu2S+2H+=Cu+Cu2++H2S↑、CuO+2H+=Cu2++H2O、FeO+2H+=Fe2++H2O、Fe2O3+6H+=2Fe3++3H2O,所以滤渣1是S;向滤液中加入氨水调节溶液的pH值至2.5-3,铁离子生成Fe(OH)3沉淀,所以滤渣2是Fe(OH)3,过滤,向滤液中加入氨气、碳酸氢铵,得到MnCO3沉淀,过滤,得到的滤渣3为MnCO3,得到的滤液中含有Cu(NH3)4CO3,加热Cu(NH3)4CO3得到CuO,反应方程式为Cu(NH3)4CO3$\frac{\underline{\;\;△\;\;}}{\;}$CuO+4NH3↑+CO2↑,CuO、Cu和饱和食盐水、盐酸反应生成 Na[CuCl2],反应方程式为Cu+CuO+2NaCl+2HCl=2 Na[CuCl2]+H2O,加入水过滤,滤渣酸洗、醇洗、干燥得到CuCl,滤液4中含有NaCl或NaCl、HCl;
(1)步骤①浸取时,发生的反应之一为CuS被MnO2氧化为S,MnO2被还原为MnSO4,根据反应物、生成物及转移电子守恒配平方程式;
(2)滤渣2为铁离子生成的氢氧化铁沉淀;
(3)步骤⑤Cu(NH3)4CO3发生的分解反应;热解生成的CO2为共价化合物,C原子和每个O原子之间共用2对电子;
(4)制取Na[CuCl2]时,反应物是Cu、CuO、NaCl和盐酸,产物是Na[CuCl2]和水,滤液4中为未反应的滤液4中为未反应的NaCl或NaCl和HCl;
(5)醇能除去酸,且具有易挥发性.
解答 解:铜矿(含CuS、Cu2S、CuO以及杂质FeO、Fe2O3)中加入稀硫酸、二氧化锰,CuS和二氧化锰、稀硫酸发生氧化还原反应,发生的离子反应方程式为CuS+MnO2+4H+=Cu2++Mn2++S+2H2O,Cu2S、CuO以及杂质FeO、Fe2O3分别与稀硫酸反应离子方程式为Cu2S+2H+=Cu+Cu2++H2S↑、CuO+2H+=Cu2++H2O、FeO+2H+=Fe2++H2O、Fe2O3+6H+=2Fe3++3H2O,所以滤渣1是S;向滤液中加入氨水调节溶液的pH值至2.5-3,铁离子生成Fe(OH)3沉淀,所以滤渣2是Fe(OH)3,过滤,向滤液中加入氨气、碳酸氢铵,得到MnCO3沉淀,过滤,得到的滤渣3为MnCO3,得到的滤液中含有Cu(NH3)4CO3,加热Cu(NH3)4CO3得到CuO,反应方程式为Cu(NH3)4CO3$\frac{\underline{\;\;△\;\;}}{\;}$CuO+4NH3↑+CO2↑,CuO、Cu和饱和食盐水、盐酸反应生成 Na[CuCl2],反应方程式为Cu+CuO+2NaCl+2HCl=2 Na[CuCl2]+H2O,加入水过滤,滤渣酸洗、醇洗、干燥得到CuCl,滤液4中含有NaCl或NaCl、HCl;
(1)步骤①浸取时,发生的反应之一为CuS被MnO2氧化为S,MnO2被还原为MnSO4,根据反应物、生成物及转移电子守恒配平方程式为CuS+MnO2+4H+=Cu2++Mn2++S+2H2O,
故答案为:CuS+MnO2+4H+=Cu2++Mn2++S+2H2O;
(2)滤渣2为铁离子生成的沉淀是Fe(OH)3,故答案为:Fe(OH)3;
(3)步骤⑤Cu(NH3)4CO3发生的分解反应生成CuO、氨气和二氧化碳,反应方程式为Cu(NH3)4CO3$\frac{\underline{\;\;△\;\;}}{\;}$CuO+4NH3↑+CO2↑;热解生成的CO2为共价化合物,C原子和每个O原子之间共用2对电子,电子式为 ,
,
故答案为:Cu(NH3)4CO3$\frac{\underline{\;\;△\;\;}}{\;}$CuO+4NH3↑+CO2↑; ;
;
(4)制取Na[CuCl2]时,反应物是Cu、CuO、NaCl和盐酸,产物是Na[CuCl2]和水,反应方程式为Cu+CuO+2NaCl+2HCl=2 Na[CuCl2]+H2O,滤液4中为未反应的NaCl或NaCl和HCl,
故答案为:Cu+CuO+2NaCl+2HCl=2 Na[CuCl2]+H2O;
(5)醇能除去酸,且具有易挥发性,所以步骤⑧中醇洗的目的是除去表面的酸并使产品快速干燥,
故答案为:除去表面的酸并使产品快速干燥.
点评 本题考查物质制备,为高频考点,侧重考查学生获取信息、利用信息及元素化合物性质解答问题能力,涉及氧化还原反应、物质分离提纯等知识点,明确元素化合物性质、化学反应原理是解本题关键,注意分析流程图中各个阶段发生的反应及各物质成分,题目难点中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案 用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:
用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:(1)仪器A的名称是三颈烧瓶.
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.写出该反应的化学方程式CH3CH2CH2CH2OH+NaBr+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CH3CH2CH2CH2Br+NaHSO4+H2O.
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等.熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是硝酸银、高锰酸钾溶液或溴水.
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气.
(5)相关有机物的数据如下:
| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
(6)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是70%.
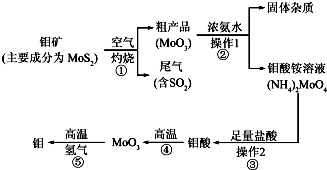
(1)写出反应①的化学方程式:2MoS2+7O2$\frac{\underline{\;高温\;}}{\;}$2MoO3+4SO2 .
(2)写出反应②的化学方程式:MoO3+2NH3•H2O=(NH4)2MoO4.
(3)反应①的尾气可以用碳酸钠溶液吸收.已知
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
A.HCO3-、HSO3- B HCO3-、SO32-
C.HCO3-、H2SO3 D HSO3-、CO32-
向过量碳酸钠溶液中通人少量二氧化硫,写出反应的离子方程式:2CO32-+SO2+H2O=SO32-+2HCO3-.
(4)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有烧杯、漏斗、玻璃棒.
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4$\frac{\underline{\;高温\;}}{\;}$2CO+2H2,CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2.含甲烷体积分数为80%的10L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为41.1g(小数点后保留1位,钼的相对原子质量为96).
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度g/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL三颈烧瓶中投入几粒沸石,将18.5mL正丁醇和13.4mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥.
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式CH3CH2CH(OH)CH3.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(3)步骤①向三颈烧瓶中依次加入的药品是:正丁醇,浓硫酸,冰醋酸.
(4)步骤②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是除去酯中混有的乙酸和正丁醇.
(5)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高,(填“高”或“低”)原因是会收集到少量未反应的冰醋酸和正丁醇.
(6)该实验生成的乙酸正丁酯的产率是65%.