题目内容
11.下列变化中,吸收的热量用于克服分子间作用力的是( )| A. | 加热金属铝使之熔化 | B. | 液态SO3受热蒸发 | ||
| C. | 加热HI气体使之分解 | D. | 加热石英晶体使之熔化 |
分析 吸收的热量用于克服分子间作用力,则对应的晶体为分子晶体,解答该题时首先判断晶体的类型,分子间作用力存在于分子晶体中,注意化学键与分子间作用力的区别,以此解答该题.
解答 解:A.铝属于金属晶体,熔化时克服金属键,故A错误;
B.液态SO3受热蒸发,克服的是分子间作用力,故B正确;
C.碘化氢分解,发生化学键的断裂,克服的是共价键,故C错误;
D.石英属于原子晶体,融化时克服共价键,故D错误.
故选B.
点评 本题考查晶体类型以及微粒间的作用力,为高频考点,题目难度不大,注意晶体的类型以及微粒间的作用力类型.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
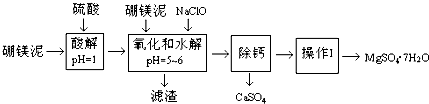
根据题意回答第(1)~(6)题:
(1)实验中需用1mol/L的硫酸800mL,若用98%的浓硫酸(ρ=1.84g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为D.A.10mLB.20mLC.50mLD.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+,如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤蒸发浓缩(结晶).“操作I”是将滤液继续蒸发浓缩,冷却结晶,趁热过滤,便得到了MgSO4•7H2O.
(6)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,则MgSO4•7H2O的产率为70%.

根据题意回答第(1)~(6)题:
(1)实验中需用1mol/L的硫酸800mL,若用98%的浓硫酸(ρ=1.84g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为D.A.10mLB.20mLC.50mLD.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+,如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,则MgSO4•7H2O的产率为70%.
17. 已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
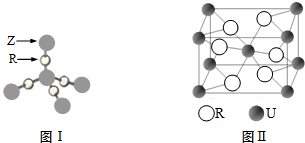
(1)AF3分子中A的杂化类型为sp3,该分子的空间构型为三角锥形.
(2)基态C原子的电子排布式为1s22s22p63s2.第一电离能:A>B(填“>”或“<”“=”).
(3)A、B、D电负性由大到小的顺序为O>N>Si(用元素符号表示).
(4)D和A形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于原子晶体.
(5)E元素与A元素形成某种化合物的晶胞结构如图所示(黑球代表E原子),若该晶体的密度为ρg•cm-3,则该晶胞的体积是$\frac{206}{ρ{N}_{A}}$cm3.
 已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:| 元素 | 特 点 |
| A | 其气态氢化物呈三角锥形,水溶液显碱性 |
| B | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
| C | 基态原子占据两种形状的原子轨道,且最外层电子数等于最内层电子数 |
| D | 元素原子的外围电子层排布式为nsn-1npn-1 |
| E | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
(2)基态C原子的电子排布式为1s22s22p63s2.第一电离能:A>B(填“>”或“<”“=”).
(3)A、B、D电负性由大到小的顺序为O>N>Si(用元素符号表示).
(4)D和A形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于原子晶体.
(5)E元素与A元素形成某种化合物的晶胞结构如图所示(黑球代表E原子),若该晶体的密度为ρg•cm-3,则该晶胞的体积是$\frac{206}{ρ{N}_{A}}$cm3.
 .
.
 ,B的结构简式
,B的结构简式 或
或 ;
;
 ;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.
;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-. 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.