题目内容
10.氯碱工业中,与铁丝网连接的是电源的( )| A. | 负极 | B. | 正极 | C. | 阴极 | D. | 阳极 |
分析 氯碱工业中,在阳极上产生氯气,在阴极上产生氢气和氢氧化钠,电解池的阳极若是活泼电极,则电极本身失电子发生氧化反应,据此回答.
解答 解:氯碱工业中,在阳极上产生氯气,在阴极上产生氢气和氢氧化钠,如果与铁丝网连接的是电源的正极,则铁为阳极,此时阳极上是金属铁失电子生成亚铁离子的氧化反应,不会产生氯气,所以金属铁必须和电源的负极相连.
故选A.
点评 本题考查学生电解原理在氯碱工业中的应用,注意阳极材料决定阳极反应是关键,也是易错点,难度中等.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
5.以NA代表阿伏加德罗常数,则关于热化学方程式C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-1411kJ•mol-1的说法中,不正确的是( )
| A. | 当12NA个电子转移时,该反应放出1411 kJ的能量 | |
| B. | 当2NA个水分子生成且为液体时,放出1411 kJ的能量 | |
| C. | 当8NA个碳氧共用电子对生成时,放出1411 kJ的能量 | |
| D. | 当8NA个碳氧双键生成时,放出1411 kJ的能量 |
2.某有机物X的结构简式如图所示,则下列有关说法中正确的是:( )


| A. | X的分子式为C12H16O3 | |
| B. | 可用酸性高锰酸钾溶液区分苯和X | |
| C. | X在一定条件下能发生水解、酯化、加成等反应 | |
| D. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 |
19.下列各组物质中,属于同系物的是( )
| A. | 苯和丙苯 | B. | 乙苯和间二甲苯 | C. | 丁二烯和丁烯 | D. | 萘和苯 |
20.工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质.工业冶炼铜的化学方程式是:8CuFeS2+2lO2 $\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和铜元素.
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验.

①滤液中的阳离子有Fe3+、Fe2+、H+、Al3+.
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是c(填序号).
③滤液在酸性条件下,与H2O2反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)冶炼铜过程中产生大量的SO2可用于制硫酸,尾气可用纯碱溶液吸收.已知用1L1mol/L的纯碱溶液吸收SO2,生成n(Na2SO3):n(NaHSO3)=1:2,则吸收的SO2物质的量是1.5mol.
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和铜元素.
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验.

①滤液中的阳离子有Fe3+、Fe2+、H+、Al3+.
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是c(填序号).
| 实验方案 | 预期现象 | |
| a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
| b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
| C | 加酸性KMnO4溶液 | 紫色褪去 |
| d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
(3)冶炼铜过程中产生大量的SO2可用于制硫酸,尾气可用纯碱溶液吸收.已知用1L1mol/L的纯碱溶液吸收SO2,生成n(Na2SO3):n(NaHSO3)=1:2,则吸收的SO2物质的量是1.5mol.

 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.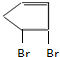 、
、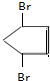 .
.