题目内容
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-、I-、SO42-、Na+、Mg2+、Ca2+等,都是重要资源.开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图:
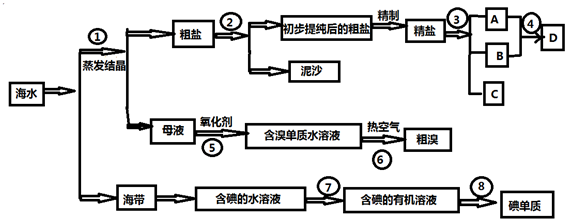
请根据以上信息回答下列问题:
(1)写出步骤②、⑦、⑧分离提纯的方法:
② ⑦ ⑧ .
(2)步骤⑦分离提纯过程中需要选用的玻璃仪器的名称 .
(3)D具有杀菌消毒的作用,请写出反应④的化学方程式并标出其电子转移的方向和数目 .
(4)初步提纯后的粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
①盐酸 ②氯化钡溶液 ③氢氧化钠溶液 ④碳酸钠溶液,
下列试剂添加顺序合理的是 .
A.②③④①B.③④②①C.④③②①D.③②④①
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是 .
A.从外地购买B.在当地新建生产厂C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有 性.

请根据以上信息回答下列问题:
(1)写出步骤②、⑦、⑧分离提纯的方法:
②
(2)步骤⑦分离提纯过程中需要选用的玻璃仪器的名称
(3)D具有杀菌消毒的作用,请写出反应④的化学方程式并标出其电子转移的方向和数目
(4)初步提纯后的粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
①盐酸 ②氯化钡溶液 ③氢氧化钠溶液 ④碳酸钠溶液,
下列试剂添加顺序合理的是
A.②③④①B.③④②①C.④③②①D.③②④①
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是
A.从外地购买B.在当地新建生产厂C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有
考点:海水资源及其综合利用
专题:
分析:(1)根据每一步所得到的物质判断使用操作方法;
(2)萃取需要选用主要玻璃仪器为分液漏斗、烧杯;
(3)反应④是氯气和氢氧化钠反应生成次氯酸、氯化钠和水,根据得失电子数相等书写;
(4)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
(5)生产烧碱时有氯气生成,生产镁时也有氯气生成;
(6)溴是易挥发的液体.
(2)萃取需要选用主要玻璃仪器为分液漏斗、烧杯;
(3)反应④是氯气和氢氧化钠反应生成次氯酸、氯化钠和水,根据得失电子数相等书写;
(4)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
(5)生产烧碱时有氯气生成,生产镁时也有氯气生成;
(6)溴是易挥发的液体.
解答:
解:(1)步骤②为过滤,粗盐经提纯化学处理后过滤可得到氯化钠溶液,⑦为碘的萃取和分液,⑧为从有机溶剂中提取碘单质,需要蒸馏,
故答案为:过滤;萃取、分液;蒸馏;
(2)步骤②分离提纯方法为萃取,需要选用主要玻璃仪器为分液漏斗、烧杯,故答案为:分液漏斗、烧杯;
(3)反应④是氯气和氢氧化钠反应生成次氯酸、氯化钠和水, ,故答案为:
,故答案为: ;
;
(4)因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为②③④①或③②④①,
故答案为:AD;
(5)取Br2,反应⑤所用的气态氧化剂为氯气,本厂生产烧碱为电解氯化钠溶液,产物中有氯气,本厂生产镁单质,通过电解无水氯化镁得到的产物为镁和氯气,
故答案为:C;
(6)溴单质具有挥发性,将溴单质从混合物中分离出来是基于溴单质的挥发性,故答案为:挥发.
故答案为:过滤;萃取、分液;蒸馏;
(2)步骤②分离提纯方法为萃取,需要选用主要玻璃仪器为分液漏斗、烧杯,故答案为:分液漏斗、烧杯;
(3)反应④是氯气和氢氧化钠反应生成次氯酸、氯化钠和水,
 ,故答案为:
,故答案为: ;
;(4)因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为②③④①或③②④①,
故答案为:AD;
(5)取Br2,反应⑤所用的气态氧化剂为氯气,本厂生产烧碱为电解氯化钠溶液,产物中有氯气,本厂生产镁单质,通过电解无水氯化镁得到的产物为镁和氯气,
故答案为:C;
(6)溴单质具有挥发性,将溴单质从混合物中分离出来是基于溴单质的挥发性,故答案为:挥发.
点评:本题考查了海水资源的综合利用,侧重于学生的分析能力和实验能力的考查,体现化学来源于生产、生活,又服务于生产、生活的理念,题目难度中等.

练习册系列答案
相关题目
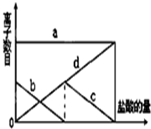 少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )
少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )| A、a:Cl-b:K+ c:CO32- d:HCO3- |
| B、a:K+ b:CO32- c:Cl- d:HCO3- |
| C、a:K+ b:CO32- c:HCO3- d:Cl- |
| D、a:K+b:HCO3- c:Cl- d:CO32- |
氰气的化学式为(CN)2,它的性质和卤素相似,称为拟卤素,对其性质和有关化合物性质的叙述不正确的是( )
| A、AgCN难溶于水 |
| B、MnO2不能与HCN反应生成(CN)2 |
| C、HCN易形成白雾 |
| D、(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O |
湿润的蓝色石蕊试纸放入盛有Cl2的集气瓶中,对观察到的现象描述正确的是( )
| A、变红 | B、先变红后褪色 |
| C、变白 | D、不变色 |
已知:MnO4-+H2O2+H+-Mn2++O2↑+H2O(未配平),若反应中转移2mol电子,则参加反应的H+的物质的量是( )
| A、2.0 mol |
| B、1.6 mol |
| C、1.2 mol |
| D、0.8 mol |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,含有NA个氦原子的氦气的体积约为11.2L |
| B、标准状况下,44.8L H2O的分子数为2NA |
| C、常温常压下,22g CO2含有原子总数为1.5NA |
| D、含有1mol HCl 的稀盐酸与足量的铁发生反应,转移的电子总数为2NA |
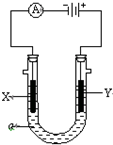 (1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度很小的环境中,该原电池的负极是
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度很小的环境中,该原电池的负极是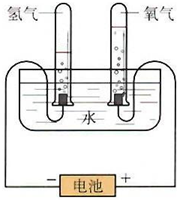 某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究.请按要求填写.
某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究.请按要求填写.