题目内容
19.下列说法正确的是( )| A. | 取用金属钠时,多余的钠应该置于废液槽中,不应放回原试剂瓶中 | |
| B. | 用足量的稀硫酸可以除去Cu粉中混有的Fe2O3杂质 | |
| C. | 在托盘天平上称取2.0g氢氧化钠固体,然后在l00mL容量瓶内溶解并稀释至刻度线,得到0.50 mol/L氢氧化钠溶液 | |
| D. | KMnO4和SO2的反应速率可通过分光光度计用比色法测出不同反应时刻的浓度来计算 |
分析 A.取用金属钠或钾做完实验后,剩余的药品要放回原瓶;
B.Cu可与硫酸铁反应;
C.容量瓶不能溶解物质;
D.分光光度计是根据溶液颜色与反应物(或生成物)浓度的关系(即比色分析)来分析使用的仪器.
解答 解:A.试剂瓶中的钠是块状固体而不是粉末状固体,不像一些粉末状的药物一旦受污染就不易清除,故A错误;
B.Fe2O3与硫酸反应生成硫酸铁,Cu可与硫酸铁反应,故B错误;
C.容量瓶不能溶解物质,应在烧杯中溶解,故C错误;
D.分光光度计可测定溶液颜色与反应物(或生成物)浓度的关系,则通过分光光度计用比色法测出不同反应时刻的浓度来计算反应速率,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、溶液的配制以及反应速率的测定等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的综合考查,注意实验的评价性分析,题目难度中等.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
14. 中国女药学家屠呦呦因成功提取青离素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
中国女药学家屠呦呦因成功提取青离素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
 中国女药学家屠呦呦因成功提取青离素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
中国女药学家屠呦呦因成功提取青离素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )| A. | 青蒿素的分子式是C15H22O5 | B. | 青蒿素在碱性条件下不能稳定存在 | ||
| C. | 青蒿素所有碳原子均在同一平面上 | D. | 青蒿素可以发生氧化反应 |
4.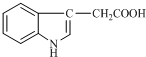 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )| A. | 吲哚乙酸与苯丙氨酸互为同分异构体 | |
| B. | 1 mol吲哚乙酸与足量氢气发生加成反应时,可以消耗5 mol H2 | |
| C. | 吲哚乙酸苯环上的二氯代物共有四种结构 | |
| D. | 吲哚乙酸可以发生取代反应、加成反应、氧化反应和还原反应 |
11.下列根据实验现象得出的结论正确的是( )
| 实验 | 现象 | 结论 | |
| A | 将饱和食盐水滴入工业电石得到的气体通入酸性KMnO4溶液中 | KMnO4溶液紫红色褪去 | 证明生成了乙炔气体 |
| B | 将BaSO4与浓Na2CO3溶液混合后振荡静置,过滤并洗净所得的沉淀,往滴加足量盐酸 | 产生使澄清石灰水变浑浊的气体 | Ksp(BaCO3)<Ksp(BaSO4) |
| C | 充分加热花生油与NaOH混合溶液(已加沸石) | 溶液不再分层 | 花生油的水解反应已经趋于完全 |
| D | 向含KSCN的FeI2溶液中滴加足量氯水 | 溶液变为血红色 | 还原性:Fe2+>I- |
| A. | A | B. | B | C. | C | D. | D |
8.下列各组物质的溶液,不加任何试剂就能将其一一区别出来的是( )
| A. | Ba2Cl2、CuSO4、NaOH、NaCl | B. | Na2SO4、BaCl2、K2CO3、KNO3 | ||
| C. | FeCl3、NaOH、Na2SO4、Ba(NO3)2 | D. | NaCl、Na2CO3、Ca(NO3)2、H2SO4 |
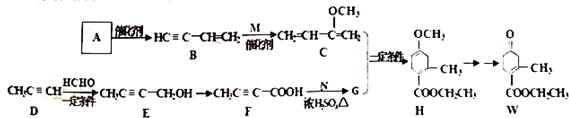
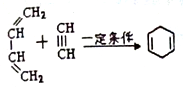 ,请回答下列问题:
,请回答下列问题: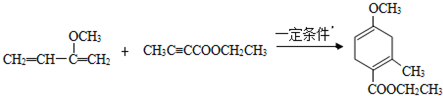 .
.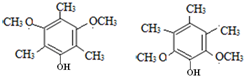 .
.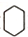 )的合成路线(在相应位置填写有关反应条件及物质的结构简式):
)的合成路线(在相应位置填写有关反应条件及物质的结构简式): $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$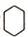

 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$

 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$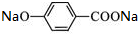 +
+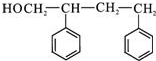 +H2O.
+H2O. (写出其中一种的结构简式).
(写出其中一种的结构简式).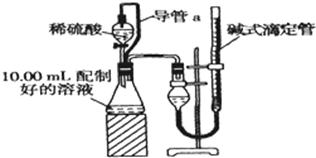 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.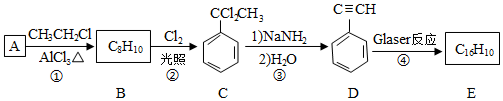
 ,D的化学名称为苯乙炔.
,D的化学名称为苯乙炔. .用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.
.用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.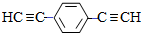 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n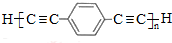 +(n-1)H2.
+(n-1)H2.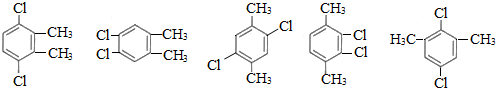 任意三种.
任意三种.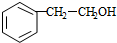 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$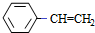 $\stackrel{Br_{2}/H_{2}O}{→}$
$\stackrel{Br_{2}/H_{2}O}{→}$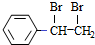 $→_{△}^{NaOH醇溶液}$
$→_{△}^{NaOH醇溶液}$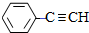 .
.