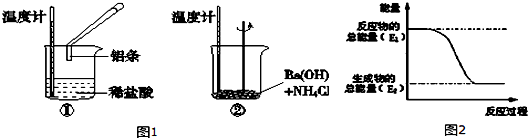
题目内容
11.阴离子Xn-1含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是( )| A. | $\frac{A}{a}$(N-a) mol | B. | $\frac{a}{A+n}$(n+A)mol | C. | $\frac{A}{a+n}$(N+n) mol | D. | $\frac{a}{A+n}$(A-N+n) mol |
分析 根据质量数=质子数+中子数,计算X的质子数.由阴离子Xn-可知X元素的气态氢化物化学式为HnX,根据n=$\frac{m}{M}$计算氢化物HnX的物质的量,结合化学式计算含有的质子的物质的量.
解答 解:阴离子Xn-含中子N个,X的质量数为A,所以X的质子数为A-N,
由阴离子Xn-可知X元素的气态氢化物化学式为HnX,所以1个HnX分子中含有的质子数为A-N+n,
氢化物HnX的摩尔质量为(A+n)g/mol,
mgX元素的气态氢化物中含质子的物质的量$\frac{ag}{(A+n)g/mol}$×(A-N+n)=$\frac{a}{A+n}$(A-N+n)mol.
故选D.
点评 本题考查学生利用原子构成的计算,明确氢化物的分子式是解题关键,注意质量数近似等于相对原子质量.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
1.下列电子式正确的是( )
| A. | 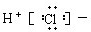 | B. | 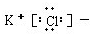 | C. | Cl:Cl | D. | 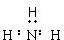 |
19.下列有机物的命名中错误的是( )
| A. | 3,4-二甲基-4-乙基庚烷 | B. | 3,5-二甲基-3-庚烯 | ||
| C. | 3-乙基-1-辛烯 | D. | 2,4,4-三甲基戊烷 |
16.已知元素Se位于第四周期ⅥA族,下列说法不正确的是( )
| A. | Se的原子序数为34 | B. | 单质Se在空气中燃烧可生成SeO3 | ||
| C. | 可形成Na2SeO3、Na2SeO4两种盐 | D. | H2S比H2Se稳定 |
3.能证明氮元素比磷元素非金属性强的事实是( )
| A. | 氮气在常温下是气体,而磷单质是固体 | |
| B. | N2在空气中不能燃烧,而磷能在空气中燃烧 | |
| C. | NH3极易溶于水,而PH3难溶于水 | |
| D. | 硝酸比磷酸酸性强 |
20.下列说法中错误的是( )
| A. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱 | |
| C. | 钾与水的反应比钠与水的反应更剧烈 | |
| D. | 溴单质与水的反应比氯单质与水的反应更剧烈 |
 H++HS-,HS-
H++HS-,HS-