题目内容
1.下列关于物质熔点的排列顺序,不正确的是( )| A. | HI>HBr>HCl>HF | B. | CI4>CBr4>CCl4>CF4 | ||
| C. | NaCl>NaBr>KBr | D. | 金刚石>碳化硅>晶体硅 |
分析 一般情况下,不同类型的晶体,熔点:原子晶体>离子晶体>分子晶体,分子晶体,取决于分子间作用力强弱,离子晶体,熔沸点取决于离子键的强弱,离子半径越小,所带电荷数越多,离子键越强,熔沸点越高,原子晶体,熔沸点高低与共价键的强弱有关,半径越小共价键越强,熔沸点越高,据此分析.
解答 解:NaCl属于离子晶体,SiO2属于原子晶体,CO2属于分子晶体,Na属于金属晶体,一般情况下,不同类型的晶体,熔点:原子晶体>离子晶体>分子晶体,
A、HI、HBr、HCl、HF为分子晶体,取决于分子间作用力强弱,但HF中能形成分子间氢键,沸点反常的高,故A错误;
B、CI4、CBr4、CCl4、CF4为分子晶体,取决于分子间作用力强弱,相对分子质量越大沸点越高,故B正确;
C、NaCl、NaBr、KBr为离子晶体,熔沸点取决于离子键的强弱,离子半径越小,所带电荷数越多,离子键越强,熔沸点越高,同族从上到下,半径增大,故C正确;
D、金刚石>碳化硅>晶体硅为原子晶体,熔沸点高低与共价键的强弱有关,半径越小共价键越强,熔沸点越高,C-C键半径最小,C-Si键其次,Si-Si键最长,故D正确;
故选A.
点评 本题考查晶体的熔沸点高低的比较,题目难度不大,注意比较晶体熔沸点高低的角度.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
11.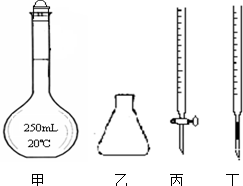 高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
(1)高锰酸钾溶液应配成中性溶液并保存在棕色试剂瓶中(填保存的注意事项).
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:
2MnO4-+5C2O42-+16H+--2Mn2++CO2↑+8H2O
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如表:
请分析高锰酸钾溶液褪色时间变化的原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)大催化效果更好.
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
①高锰酸钾溶液应装在丙(填图中的仪器编号).
②若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是AC.
A.未润洗盛放KMnO4的滴定管 B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线 D.锥形瓶用水洗之后未用待测液润洗
③该滴定达到终点的标志为逐滴滴入高锰酸钾溶液,当滴入最后一滴高锰酸钾溶液时,溶液由无色变为紫红色,且半分钟内不褪色,最终消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为0.0200mol/L(取4位有效数字).
 高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.(1)高锰酸钾溶液应配成中性溶液并保存在棕色试剂瓶中(填保存的注意事项).
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:
2MnO4-+5C2O42-+16H+--2Mn2++CO2↑+8H2O
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如表:
| 滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
①高锰酸钾溶液应装在丙(填图中的仪器编号).
②若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是AC.
A.未润洗盛放KMnO4的滴定管 B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线 D.锥形瓶用水洗之后未用待测液润洗
③该滴定达到终点的标志为逐滴滴入高锰酸钾溶液,当滴入最后一滴高锰酸钾溶液时,溶液由无色变为紫红色,且半分钟内不褪色,最终消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为0.0200mol/L(取4位有效数字).
9.在一定温度下,在恒压的密闭容器中进行的可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | 混合气体密度保持不变 | |
| B. | 单位时间内生成n mol A,同时生成3n mol B | |
| C. | 混合气体的压强保持不变 | |
| D. | C生成的速率与A分解的速率相等 |
16.下列措施肯定能使化学反应速率加快的是( )
| A. | 增加反应物的量 | B. | 增加压强 | C. | 升高温度 | D. | 缩小容器的体积 |
6.下列说法正确的是( )
| A. | 晶体在受热熔化过程中一定存在化学键的断裂 | |
| B. | 原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 | |
| C. | 区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验 | |
| D. | 非金属元素的原子间只形成共价键,金属元素的原子非金属元素的原子间只形成离子键 |
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: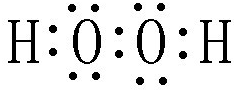 .
. 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题:
 .
. .
.