题目内容
4.回答下列问题:(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为SO2和Fe3O4,若有3mol FeS2参加反应,转移电子数为32NA.
(2)与明矾相似,硫酸铁也可用作净水剂,其原理为Fe3++3H2O?Fe(OH)3+3H+(用离子方程表示)
(3)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请写出相应的离子方程式3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
分析 (1)反应3FeS2+8O2=Fe3O4+6SO2中Fe元素化合价又+2→+3,化合价升高,S元素化合价由-1→+4,化合价升高,O元素化合价由0→-2,化合价降低;
(2)三价铁离子水解生成氢氧化铁胶体和氢离子;
(3)硝酸根离子在酸性环境下具有强的氧化性,能够氧化二价铁离子生成三价铁离子;
解答 解:(1)反应3FeS2+8O2=Fe3O4+6SO2,前后各元素化合价的变化情况如下:
Fe:+2→+3,化合价升高;S:-1→+4,化合价升高;O:0→-2,化合价降低;
因此,在反应中FeS2还原剂,O2是氧化剂,Fe3O4既是氧化产物也是还原产物,SO2既是氧化产物也是还原产物;在上述反应中共转移32个电子,有3molFeS2参加反应,转移电子的物质的量为32mol,所以电子转移数为32NA,
故答案为:SO2和Fe3O4;32NA;
(2)与明矾相似,硫酸铁也可用作净水剂,离子方程式:Fe3++3H2O?Fe(OH)3+3H+;
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(3)硝酸根离子在酸性环境下具有强的氧化性,能够氧化二价铁离子生成三价铁离子,反应的离子方程式:3Fe2++NO3-+4 H+=3 Fe3++NO↑+2 H2O;
故答案为:3Fe2++NO3-+4 H+=3 Fe3++NO↑+2 H2O.
点评 本题考查了氧化还原反应基本概念判断电子转移数目计算,离子方程式的书写,明确氧化还原反应规律,离子反应实质是解题关键,注意盐类水解的应用,题目难度不大.

练习册系列答案
相关题目
14.下列实验装置设计正确,且能达到目的是( )
| A. | 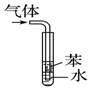 吸收氨气,并防止倒吸 | B. | 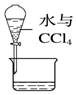 分离水和CCl4 | ||
| C. | 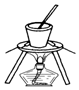 从食盐水中提取NaCl | D. | 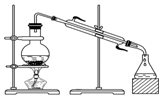 石油的分馏 |
15.某KCl、MgCl2,、Mg(NO3)2形成的混合中,c(K+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.1mol/L,则c(NO3-)为( )
| A. | 0.15mol/L | B. | 0.10mol/L | C. | 0.25mol/L | D. | 0.40mol/L |
12.下列配离子中最稳定的离子是( )
| A. | [AgCl2]- | B. | [Ag(NH3)2]+ | C. | [Ag(S2O3)2]3- | D. | [Ag(CN)2]- |
19.模拟电渗析法将海水淡化的工作原理示意图.己知X、Y均为惰性电极,模拟海水中富含Na+、Cl-、Ca2+、Mg2+、SO42-等离子.下列叙述中正确的是( )


| A. | N是阴离子交换膜 | B. | Y电极上产生有色气体 | ||
| C. | X电极区域有浑浊产生 | D. | X电极反应式为4OH--4e-=O2↑+2H2O |
9.化学与人类生产、生活密切相关,下列有关说法正确的是( )
| A. | 浓硫酸具有吸水性,可作食品干燥剂 | |
| B. | 夏天雷雨过后感觉到空气清新是因为产生了少量NO2 | |
| C. | 缤纷绚丽的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 | |
| D. | 明矾可以使海水淡化,从而解决“淡水供应危机” |
16.下列化学反应的离子方程式表示正确的是( )
| A. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| B. | 向Ca(HCO3)2溶液中滴加少量Ba(OH)2溶液:Ca2++2HCO3-+Ba2++2OH-═CaCO3↓+BaCO3↓+2H2O | |
| C. | 向NaHSO4溶液中加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | Fe(OH)2沉淀中滴加稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
13.化合物X和Y互为同分异构体,下列说法正确的是( )
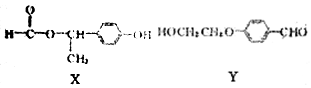
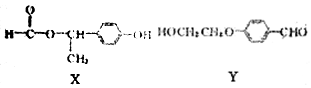
| A. | 物质X中只含1个手性碳原子 | |
| B. | FeCl3溶液和银氨溶液均可鉴别X和Y | |
| C. | 物质Y在NaOH醇溶液中能发生消去反应 | |
| D. | 1molX与NaOH溶液反应,最多消耗NaOH的物质的量为1mol |