题目内容
根据下表中部分短周期元素的原子半径及主要化合价判断,下列叙述正确的是( )
|
分析:短周期元素R、T都有-2价,应位于周期表第ⅥA族,其中R有+6价,则T为O元素,R为S元素,Q比T的原子半径略大,最高化合价为+5价,应为N元素,L的化合价为+2价,由原子半径可确定L为Mg,M的最高正价为+3价,由原子半径关系可确定M为Al,结合元素对应单质混合物的性质以及元素周期律知识解答该题.
解答:解:短周期元素R、T都有-2价,应位于周期表第ⅥA族,其中R有+6价,则T为O元素,R为S元素,Q比T的原子半径略大,最高化合价为+5价,应为N元素,L的化合价为+2价,由原子半径可确定L为Mg,M的最高正价为+3价,由原子半径关系可确定M为Al,
A.L2+与T2-具有相同的核外电子排布,核电荷数越大,离子半径越小,故A错误;
B.非金属性O>S,非金属性越强,对应的氢化物的还原性越弱,故B错误;
C.M与T形成的化合物为Al2O3,具有两性,既可与酸反应,也可与碱反应,故C错误;
D.由于O的非金属性比N强,则一定条件下,O的单质可将N从其氢化物中置换出来,故D正确.
故选D.
A.L2+与T2-具有相同的核外电子排布,核电荷数越大,离子半径越小,故A错误;
B.非金属性O>S,非金属性越强,对应的氢化物的还原性越弱,故B错误;
C.M与T形成的化合物为Al2O3,具有两性,既可与酸反应,也可与碱反应,故C错误;
D.由于O的非金属性比N强,则一定条件下,O的单质可将N从其氢化物中置换出来,故D正确.
故选D.
点评:本题考查原子结构与元素周期律的关系,明确元素的种类为解答该题的关键,注意把握原子结构特点,本题侧重于化合价和原子半径的角度的考查,注意化合价可确定元素在周期表中的位置,结合元素周期律的递变解答,题目难度中等.

练习册系列答案
相关题目
根据下表中部分短周期元素的原子半径及主要化合价信息,
|
根据下表中部分短周期元素的原子半径及主要化合价判断,下列叙述正确的是
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.075 |
0.102 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+5、+3 |
+6、-2 |
-2 |
A. 离子半径: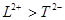
B. 氢化物的还原性:
C. M与T形成的化合物只能与盐酸反应,不与 溶液反应
溶液反应
D. 一定条件下,T的单质可将Q从其氢化物中置换出来
根据下表中部分短周期元素的原子半径及主要化合价判断,下列叙述正确的是( )
A.离子半径:L2+>T2-
B.氢化物的还原性:H2T>H2R
C.M与T形成的化合物只能与盐酸反应,不与NaOH溶液反应
D.一定条件下,T的单质可将Q从其氢化物中置换出来
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.075 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +5、+3 | +6、-2 | -2 |
A.离子半径:L2+>T2-
B.氢化物的还原性:H2T>H2R
C.M与T形成的化合物只能与盐酸反应,不与NaOH溶液反应
D.一定条件下,T的单质可将Q从其氢化物中置换出来