题目内容
由Cu2+、Cl-、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铁电极、铜电极、铂电极进行电解实验.
(1)欲使铁制品表面镀铜,应以 为阳极,电解质溶液为 .
(2)以铂作阳极电解 溶液时,溶液的碱性有明显增强,且溶液保澄清,电解时总反应的化学方程式为 .
(1)欲使铁制品表面镀铜,应以
(2)以铂作阳极电解
考点:电解原理
专题:电化学专题
分析:(1)电镀时,镀层作阳极、镀件作阴极,电解质为可溶性的含有阳极金属元素的盐;
(2)以铂作阳极电解时,溶液的碱性有明显增强,且溶液保澄清,什么阴极上氢离子放电.
(2)以铂作阳极电解时,溶液的碱性有明显增强,且溶液保澄清,什么阴极上氢离子放电.
解答:
解:(1)电镀时,镀层作阳极、镀件作阴极,电解质为可溶性的含有阳极金属元素的盐,所以铜作阳极、电解质为硫酸铜或氯化铜溶液,故答案为:铜;硫酸铜或氯化铜溶液;
(2)以铂作阳极电解氯化钠溶液时,阴极电极反应式为:2H2O+2e-=H2 ↑+2OH-,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,同时生成氢氧化钠,所以其电池反应式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,所以溶液中氢离子浓度逐渐减小,pH值逐渐变大,且溶液保持澄清,
故答案为:NaCl;2NaCl+2H2O
2NaOH+H2↑+Cl2↑.
(2)以铂作阳极电解氯化钠溶液时,阴极电极反应式为:2H2O+2e-=H2 ↑+2OH-,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,同时生成氢氧化钠,所以其电池反应式为:2NaCl+2H2O
| ||
故答案为:NaCl;2NaCl+2H2O
| ||
点评:本题考查了电解池原理及其应用,明确各个电极上发生的反应是解本题关键,难度不大.

练习册系列答案
相关题目
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 物质编号 | 物质转化关系 | a | b | c | d |
| 1 | 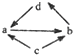 | FeCl2 | FeCl3 | Fe | CuCl2 |
| ② | NO | NO2 | O2 | HNO3 | |
| ③ | CH2=CH2 | CH3-CH3 | HC≡CH | CH3CH2Cl | |
| ④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| A、①②③④ | B、①②③ |
| C、①③④ | D、②④ |
 利用常温下氨气与氯气能发生置换反应的性质,在氯碱工业生产中用氨来检查氯气是否泄漏,其模拟装置如图.下列有关说法不正确的是( )
利用常温下氨气与氯气能发生置换反应的性质,在氯碱工业生产中用氨来检查氯气是否泄漏,其模拟装置如图.下列有关说法不正确的是( )| A、烧瓶中会出现白烟 |
| B、烧瓶中会立即出现喷泉 |
| C、烧瓶中发生的反应表明常温下氨气有还原性 |
| D、烧瓶内氨气与氯气发生的反应中,氧化剂与还原剂物质的量之比是3:2 |
某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是( )
| A、K+、NH4+、Cl-、SO42- |
| B、Cu2+、Fe2+、NO3-、SO42- |
| C、Na+、Ca2+、Cl-、ClO- |
| D、Na+、K+、Cl-、SO42- |
在不同温度下,向2L密闭容器中加入1mol NO和1mol活性炭,发生反应:2NO(g)+C(s)═N2(g)+CO2(g)△H=-213.5kJ/mol,达到平衡时的数据如下:下列说法不正确的是( )
| 温度/℃ | n(活性炭)/mol | n(CO2)/mol |
| T1 | 0.70 | |
| T2 | 0.25 |
| A、上述信息可推知:T1<T2 | ||
B、T1℃时,该反应的平衡常数K=
| ||
| C、T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)不变 | ||
| D、T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小 |
在2L密闭容器中放入CO(g)、H2O(g)各1mol,发生CO(g)+H2O(g)?CO2(g)+H2(g)△H>0的反应.改变下列条件,不能使v正增大的是( )
| A、升高温度 |
| B、降低温度 |
| C、使用催化剂 |
| D、压缩容器,使其体积变为1 L |
下列有关化学用语表示错误的是( )
| A、HCN的结构式:H-C≡N |
B、HClO的电子式为: |
C、HOCH2COOH缩聚物的结构简式: |
D、2-氯甲苯的结构简式: |
将0.2mol?L-1 HCN溶液和0.1mol?L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是( )
| A、c(HCN)<c(CN-) |
| B、c(Na+)=c(CN-) |
| C、c(HCN)-c(CN-)=c(OH-) |
| D、c(HCN)+c(CN-)=0.1 mol?L-1 |