题目内容
(14分)
(1)与OH-电子数和质子数均相同的单核微粒的离子结构示意图为____________
(2)250C时,2.3 g酒精在血液中被氧气完全氧化放出66.8 kJ热量,该反应的热化学方程式为________________(3)汽车安全气囊中含MYn和红棕色金属氧化 物。M、Y为短周期元素,其最外层电子数之和等于氧原子的最外层电子数,且可发生下图的转化。

①写出元素符号:M______;Y_______.
②在2L密闭容器中,起始投入2 mol Y2和3.5 mol H2发生反应II,测得平衡时的数据如表。

若该反应ΔH <0,则T1______T2(填“ >”、“ <”或“=”);在温度T2下,若经过10 min反应达到平衡,则平均速率v(YH3)= ______,平衡常数为______ (保留两位有效数字)
③反应III的化学方程式 为___________________。
23.(14分)(1)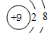
(2)C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l) △H =-1336 kJ · mol – 1
(3)①Na N ② <; 0.05mol ·L―1 ·min―1 0.33(mol ·L―1)―2或0.33(L2 ·mol―2)
③2NH3 + NaClO =N2H4 + NaCl + H2O
【解析】
试题分析:(1)与OH-电子数为10,质子数为9,含有9个质子10个电子的单核离子为氟离子,其结构示意图为: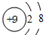 ,
,
(2)2.3g酒精的物质的量为0.05mol,0.05mol乙醇在血液中被氧气完全氧化放出66.8kJ热量,则1mol乙醇完全反应放出的热量为:66.8kJ×1/0.05=1336kJ,乙醇燃烧的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l),△H=-1336 kJ?mol-1;
(3)①M、Y为短周期元素,其最外层电子数之和等于氧原子的最外层电子数,说明最外层电子数之和为6;由Y的氢化物为YH3可知,Y最外层5个电子,则M最外层1个电子,再根据图示转化关系分析,M为金属钠,Y为N;②该反应△H<0,温度升高,氨气的含量会减小,由表中数据可知,T1<T2;若经过10min反应达到平衡,则平均速率v(NH3)=1/(2X10)=0.05mol/(L?min);根据反应方程式:N2(g)+3H2(g)═2NH3,该温度下,达到平衡状态时各组分的浓度为:c(NH3)=0.5ol/L,c(H2)=(3.5-1.5)/2=1mol/L,c(N2)=(2-0.5)/2=0.75mol/L,平衡常数为:K=(0.5)2/(0.75)?13=0.33;
③反应Ⅲ为氨气与次氯酸钠的反应,其反应的化学方程式为:2NH3+NaClO═N2H4+NaCl+H2O
考点:考查10电子微粒,热化学方程式,物质的推断,化学反应速率的计算,化学平衡常数等知识。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案