题目内容
6.实验室制取高锰酸钾必须用锰酸钾(K2MnO4)配成电解质溶液,以铁、石墨分别作电极进行电解.有关此制备实验的下列叙述中,正确的是( )| A. | 石墨为阴极,阳极上有气体产生 | |
| B. | 铁作阳极,阴极的反应式为2H++2e-═H2 | |
| C. | 铁作阴极,阳极的反应式为2 MnO42--2e-═2 MnO4- | |
| D. | 石墨为阳极,阴极的反应式为2 MnO42--2e-═2 MnO4- |
分析 实验室制取高锰酸钾必须用锰酸钾(K2MnO4)配成电解质溶液,锰元素化合价+6价变化为+7价需要发生氧化反应得到,以铁、石墨分别作电极进行电解,则阳极上是锰酸根离子失电子发生氧化反应,阴极上是溶液中氢离子得到电子发生还原反应,据此分析判断.
解答 解:实验室制取高锰酸钾必须用锰酸钾(K2MnO4)配成电解质溶液,锰元素化合价+6价变化为+7价需要发生氧化反应得到,以铁、石墨分别作电极进行电解,则阳极上是锰酸根离子失电子发生氧化反应,阴极上是溶液中氢离子得到电子发生还原反应,
A.石墨应为电解池阳极,故A错误;
B.铁只能作阴极才能保证锰酸根离子被杨宏伟高锰酸根离子,阴极的反应式为2H++2e-═H2,故B错误;
C.铁作阴极,溶液中锰酸根离子失电子发生氧化反应生成高锰酸根离子,阳极的反应式为:2 MnO42--2e-═2 MnO4-,故C正确;
D.石墨为阳极,阴极的电极反应2H++2e-═H2,故D错误;
故选C.
点评 本题考查了电解原理的分析应用,主要是电极材料、电解反应的判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
18.电解饱和食盐水可以得到重要的化工产品,其中在电解装置的阳极产生一种用途广泛的气体,用来检验该气体的方法是( )
| A. | 点燃 | B. | 闻气味 | ||
| C. | 湿润的淀粉碘化钾试纸 | D. | 干燥pH试纸 |
19.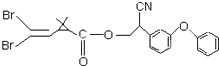 拟除虫菊酯是一类高效、低毒的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图所示,下列对该化合物的叙述中,正确的是( )
拟除虫菊酯是一类高效、低毒的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图所示,下列对该化合物的叙述中,正确的是( )
 拟除虫菊酯是一类高效、低毒的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图所示,下列对该化合物的叙述中,正确的是( )
拟除虫菊酯是一类高效、低毒的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图所示,下列对该化合物的叙述中,正确的是( )| A. | 属于芳香烃 | B. | 每一个分子内含23个碳原子 | ||
| C. | 属于高分子化合物 | D. | 每一个分子内含7个碳碳双键 |
1.已知2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-1,按不同方式向甲、乙和丙3个相同容器内投入反应物,且保持恒温、恒容,测得反应达到平衡时的有关数据如表:
下列有关关系式正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molSO2、1molO2 | 1molSO2、0.5molO2 | 2molSO3 |
| k1 | k2 | k3 | |
| 反应的能量变化 | 放出akJ | 放出bkJ | 吸收ckJ |
| 气体密度 | ρ1 | ρ2 | ρ3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | k1=k3<k2 | B. | ρ1=ρ3>ρ2 | C. | α2+α3>1 | D. | 2b+c>197 |
11.下列关于热化学反应的描述中正确的是( )
| A. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 已知反应H2S(g)+a O2(g)═X+c H2O(l)△H,若△H表示该反应的燃烧热,则X为SO2(g) |
15.某学生的实验报告所列出的下列数据中合理的是( )
| A. | .用10mL量筒量取7.28mL稀盐酸 | |
| B. | .用托盘天平称量25.50g NaCl | |
| C. | 用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.60mL | |
| D. | 用广泛pH试纸测得某溶液的pH为2.7 |