题目内容
11.下列关于热化学反应的描述中正确的是( )| A. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 已知反应H2S(g)+a O2(g)═X+c H2O(l)△H,若△H表示该反应的燃烧热,则X为SO2(g) |
分析 A.热化学方程式反写,反应热的符号相反,反应热的数值与化学计量数成正比;
B.根据中和热的定义以及生成硫酸钡沉淀的反应还要放出热量分析;
C.反应热与反应条件没有必然关系;
D.燃烧热是指1mol可燃物充分燃烧时放出的热量,S充分燃烧生成二氧化硫,不可能生成三氧化硫,二氧化硫和氧气催化氧化才能生成三氧化硫,据此分析.
解答 解:A.CO(g)的燃烧热是283.0kJ/mol,则表示燃烧热的热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol,当方程式反写△H符号相反,计量数变化几倍△H也要变化几倍,所以2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol,故A正确;
B.中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量,生成2molH2O所放出的热量为2×57.3kJ,但稀H2SO4和Ba(OH)2反应生成硫酸钡沉淀的反应还要放出热量,则H2SO4和Ba(OH)2反应的反应热小于2×(-57.3)kJ•mol-1,故B错误;
C.需要加热才能发生的反应不一定是吸热反应,如氢气燃烧、铝热反应等,故C错误;
D.燃烧热是指1mol可燃物充分燃烧时放出的热量,S充分燃烧生成的稳定氧化物为二氧化硫,所以X为SO2(g),故D正确;
故选AD.
点评 本题考查学生热化学方程式的含义、燃烧热的概念、中和热的概念等知识,明确燃烧热、中和热的概念为解答关键,C为易错点,注意反应热与反应条件之间没有必然关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.解放日报12月13日报道,甘肃发现亿吨级大油田,石油是一种重要的能源.下列关于石油的说法正确的是( )
| A. | 石油不溶于水密度比水大 | B. | 石油中主要含有碳、氢两种元素 | ||
| C. | 石油的裂化属于物理变化 | D. | 石油分馏获得的各馏分是纯净物 |
2. 如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )
如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )
 如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )
如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )| A. | 该反应的热化学方程式为 N2(g)+3H2(g)?2NH3(g),△H=-192kJ•mol-1 | |
| B. | 不用催化剂,生成 1molNH3放出的热量为92kJ | |
| C. | 曲线b表明加入催化剂,反应热减小 | |
| D. | 曲线b表明加入催化剂,反应速率加快 |
19.下列事实不能用勒沙特列原理解释的是( )
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 加入催化剂有利于氨的氧化反应 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
6.实验室制取高锰酸钾必须用锰酸钾(K2MnO4)配成电解质溶液,以铁、石墨分别作电极进行电解.有关此制备实验的下列叙述中,正确的是( )
| A. | 石墨为阴极,阳极上有气体产生 | |
| B. | 铁作阳极,阴极的反应式为2H++2e-═H2 | |
| C. | 铁作阴极,阳极的反应式为2 MnO42--2e-═2 MnO4- | |
| D. | 石墨为阳极,阴极的反应式为2 MnO42--2e-═2 MnO4- |
16.短周期中有X、Y、Z三种元素,Z可分别与X、Y组成化合物XZ2、ZY2,这三种元素原 子的核外电子数之和为30,每个XZ2分子的核外电子总数为38,由此可推知X、Y、Z依次为( )
| A. | C、O、S | B. | N、Na、Mg | C. | C、F、P | D. | N、O、P |
3.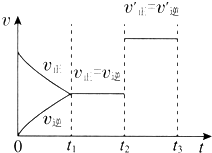 如图表示一定条件下N2+3H2?2NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是( )
如图表示一定条件下N2+3H2?2NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是( )
 如图表示一定条件下N2+3H2?2NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是( )
如图表示一定条件下N2+3H2?2NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是( )| A. | 加压 | B. | 升温 | C. | 加入催化剂 | D. | 增大反应物浓度 |
20.能作耐火材料的是( )
| A. | 氯化钠 | B. | 氧化铝 | C. | 二氧化硅 | D. | 特种钢 |
1.X是第ⅥA族的短周期元素,以下是一些该元素组成的粒子,其化学式中的n值不一定为2的是( )
| A. | 阴离子: | B. | 氧化物:XOn | C. | 气态氢化物:HnX | D. | 含氧酸:HnXO4 |