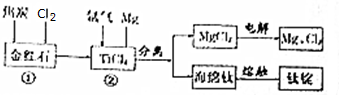
题目内容
14.欲用98%的浓硫酸(p=l.84g/cm)配制成浓度为0.5mol•L-1的稀硫酸480mL.(1)除烧杯、量筒和玻璃棒外,还需要的玻璃仪器:500mL容量瓶、胶头滴管.
(2)计算所需浓硫酸的体积为13.6ml.如果实验室有20mL、50mL、100mL的量筒应选用20mL的量简最好.
(3)下列操作会使配制溶液浓度偏高的是ad.
a.用量筒量取浓硫酸时仰视
b.容量瓶洗涤后未干燥直接使用
c.定容后摇匀,发现液面低于刻度,未补加蒸馏水至刻度
d.在转入容量瓶前烧杯中液体未冷却至室温.
分析 (1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(2)浓H2SO4的物质的量浓度c=$\frac{1000ρw}{M}$,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;选择量筒时,应根据所取液体的体积,尽量选用能一次量取的最小规格的量筒;
(3)分析操作对溶质的物质的量或溶液的体积的影响,根据c=$\frac{n}{V}$判断不当操作对所配溶液浓度影响.
解答 解:(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,配制480mL的溶液,需要选用500mL的容量瓶,实际上配制的是500mL 0.5mol•L-1的硫酸溶液,用量筒量取(用到胶头滴管)称量,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,需要使用的仪器有:烧杯、玻璃棒、量筒、500mL容量瓶、胶头滴管等,
故答案为:500mL容量瓶;胶头滴管;
(2)该浓H2SO4的物质的量浓度c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制480mL的溶液,需要选用500mL的容量瓶,实际上配制的是500mL 0.5mol•L-1的硫酸溶液,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol•L-1,解得:x≈13.6;量筒应选用20mL的量简最好;
故答案为:13.6;20;
(3)a、用量筒量取浓硫酸时仰视,浓硫酸的体积偏大,溶质的物质的量偏大,所配溶液浓度偏大,故a符合;
b、容量瓶洗涤后未干燥直接使用,对溶质、溶液的体积都无影响,所配溶液浓度无影响,故b不符合;
c、定容后摇匀发现液面低于刻度线,继续滴加蒸馏水至刻度线,导致溶液体积偏大,所配溶液浓度偏低,故c不符合;
d、在转入容量瓶前烧杯中液体未冷却至室温,溶液体积偏小,所配溶液浓度偏高,故d符合.
故选ad.
点评 本题考查了一定物质的量浓度溶液的配制、计算及误差分析,明确配制原理和容量瓶规格的选择是解题关键,题目难度不大.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| A. | 氢气 | B. | 碳水化合物 | C. | 碳氢化合物 | D. | 醇类 |
| 可能用到的燃烧热 | C2H4 | C3H6 | C3H8 |
| 单位/kJ•mol-1 | 1411 | 2092 | 2220 |
(2)此气体的化学式是C3H6.
(3)写出表示此气体燃烧热的热化学方程式C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411kJ/mol.
 如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )
如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )| A. | 该反应的热化学方程式为 N2(g)+3H2(g)?2NH3(g),△H=-192kJ•mol-1 | |
| B. | 不用催化剂,生成 1molNH3放出的热量为92kJ | |
| C. | 曲线b表明加入催化剂,反应热减小 | |
| D. | 曲线b表明加入催化剂,反应速率加快 |
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 加入催化剂有利于氨的氧化反应 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
| A. | 石墨为阴极,阳极上有气体产生 | |
| B. | 铁作阳极,阴极的反应式为2H++2e-═H2 | |
| C. | 铁作阴极,阳极的反应式为2 MnO42--2e-═2 MnO4- | |
| D. | 石墨为阳极,阴极的反应式为2 MnO42--2e-═2 MnO4- |
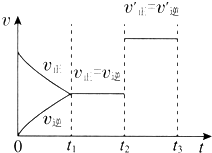 如图表示一定条件下N2+3H2?2NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是( )
如图表示一定条件下N2+3H2?2NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是( )| A. | 加压 | B. | 升温 | C. | 加入催化剂 | D. | 增大反应物浓度 |
①CuSO4 ②SO3 ③水银 ④氧化钠 ⑤盐酸 ⑥酒精 ⑦NaOH.
| A. | ①⑦ | B. | ①②⑦ | C. | ①④⑦ | D. | ②③⑤⑥⑦ |