题目内容
17.常温下,某100 mL溶液中含H2SO4 0.50 mol,加入下列物质,使溶液的导电性增强的是( )| A. | 0.50 mol Ba(OH)2 | B. | 100 mL水 | C. | 0.50 mol酒精 | D. | 0.50 mol Na2SO4 |
分析 某100 mL溶液中含H2SO4 0.50 mol,则c(H2SO4)=$\frac{0.5mol}{0.1L}$=5mol/L,与选项中的物质反应或混合后,离子浓度变大,则溶液的导电性增强,以此来解答.
解答 解:离子浓度越大,导电性越强,则
A.0.50 mol H2SO4与0.50 mol Ba(OH)2恰好反应生成硫酸钡沉淀和水,离子浓度为零,导电性变为零,故A错误;
B.加入100 mL水,离子浓度减小,导电性减弱,故B错误;
C.加入0.50 mol酒精,离子浓度减小,导电性减弱,故C错误;
D.加入0.50 mol Na2SO4,离子浓度增大,导电性增强,故D正确;
故选D.
点评 本题考查溶液的导电性,为高频考点,把握导电性与离子浓度的关系为解答的关键,侧重分析与应用能力的考查,注意离子浓度的判断,题目难度不大.

练习册系列答案
相关题目
8.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | 物质微粒数 | 标准状况下气体摩尔体积 | 固体体积 | 溶液的质量分数 | 非标准状况下物质的质量 |
| 乙 | 阿伏加德罗常数 | 标准状况下气体体积 | 固体密度 | 溶液的体积 | 物质的摩尔质量 |
| A. | ②④ | B. | ④⑤ | C. | ③④ | D. | ③ |
2.下列说法正确的是( )
| A. | 氢化物的沸点:H2O>PH3>NH3 | |
| B. | 第三周期元素(除惰性元素),随着原子序数的递增,元素的最高化合价逐渐升高 | |
| C. | 同主族元素从上到下,非金属性逐渐增强,金属性逐减弱 | |
| D. | P的非金属性强于Si,H2SiO3的酸性强于H3PO4 |
9.如图为某反应的部分微观示意图,其中不同球代表不同元素的原子.下列说法正确的是( )
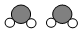 +
+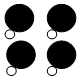 →
→ +4X.
+4X.
 +
+ →
→ +4X.
+4X.| A. | 该反应属于置换反应 | B. | 参加反应的两种分子个数比为1:1 | ||
| C. | 1个X分子中含有3个原子 | D. | 1个X分子中含有3种不同的原子 |
7.常温下,某溶液中水电离出的H+浓度为1×10-13mol•L-1,有关该溶液的说法正确的是( )
| A. | 加入铝粉一定能产生大量H2 | |
| B. | 溶液中OH-的浓度一定为0.1mol•L-1 | |
| C. | 还可能大量存在Na+、NH4+‘Cl-、S2O32- | |
| D. | 通入少量 HCl 气体可能会使溶液中水的电离程度增大 |
 .
. .
. .
.