题目内容
9.选择下列实验方法分离物质,将分离方法的序号填在横线上.A 萃取分液法 B 加热分解法 C 结晶法 D 分液法 E 过滤法 F 蒸馏法
(1)分离饱和食盐水与沙子的混合物E
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾C
(3)分离水和汽油的混合物D
(4)分离四氯化碳(沸点76.75)和甲苯(沸点110.6)的混合液F
(5)从碘的水溶液里提取碘.AF.
分析 (1)沙子不溶于水;
(2)硝酸钾和氯化钠的溶解度受温度影响不同;
(3)水和汽油分层;
(4)二者互溶,但沸点不同;
(5)碘不易溶于水,易溶于有机溶剂.
解答 解:(1)沙子不溶于水,则选择过滤法分离,故答案为:E;
(2)硝酸钾和氯化钠的溶解度受温度影响不同,则选择结晶法分离,故答案为:C;
(3)水和汽油分层,则选择分液法分离,故答案为:D;
(4)二者互溶,但沸点不同,则选择蒸馏法分离,故答案为:F;
(5)碘不易溶于水,易溶于有机溶剂,则选择有机溶剂进行萃取、分液,然后蒸馏得到碘,故答案为:AF.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意分离原理的理解,题目难度不大.

练习册系列答案
相关题目
3.X、Y、Z、W均为短周期元素,原子序数依次增大.Y原子的M电子层有1个电子,同周期的简单离子的半径中Z最小.W与X同主族,其最高化合价是最低负化合价绝对值的3倍.下列说法正确的是( )
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | 简单离子的半径:Y<X | D. | X分别与Z、W形成化合物的熔点:Z<W |
20.四种主族元素的离子aXm+、bYn+、cZn-和 dRm-具有相同的电子层结构,若m>n,则下列叙述的判断正确的是( )
①a-c=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y.
①a-c=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y.
| A. | ①②③④ | B. | ①②③ | C. | ②③ | D. | 只有③ |
4.下列各组金属只用CuSO4溶液就能确定金属活动性强弱顺序的是( )
| A. | Fe和Zn | B. | Fe和Ag | C. | Ag和Hg | D. | Mg和Zn |
1.(1)电渗析法淡化海水时阴极室可获得的重要化工原料有H2、NaOH.
(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发池和结晶池,建盐田必须在BC处建立(填序号).
A.选在离江河入海口比较近的地方B.多风少雨C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe2+、SO42-等离子,流程如下:
粗盐水$→_{过程Ⅰ}^{过量BaCl_{2}溶液}$$→_{过程Ⅱ}^{过量Na_{2}CO_{3}溶液}$$→_{过程Ⅲ}^{过量NaOH溶液}$$→_{过程Ⅳ}^{过滤}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20℃部分沉淀的溶解度(g)如表:
①检测Fe3+是否除尽的方法是取过程Ⅳ的滤液于试管中,向其中滴加KSCN溶液,若溶液不变色证明Fe3+已经沉淀干净,反之没除净;
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克.
(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发池和结晶池,建盐田必须在BC处建立(填序号).
A.选在离江河入海口比较近的地方B.多风少雨C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe2+、SO42-等离子,流程如下:
粗盐水$→_{过程Ⅰ}^{过量BaCl_{2}溶液}$$→_{过程Ⅱ}^{过量Na_{2}CO_{3}溶液}$$→_{过程Ⅲ}^{过量NaOH溶液}$$→_{过程Ⅳ}^{过滤}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20℃部分沉淀的溶解度(g)如表:
| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克.
18.“美丽中国”是十八大提出的重大课题,她突出了生态文明,重点是社会发展与自然环境之间的和谐,下列针对这一主题的说法中错误的是( )
| A. | 推广燃煤脱硫技术,减少SO2污染,同时把煤粉碎了再燃烧以提高煤的燃烧效率 | |
| B. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | |
| D. | 在汽车尾气处理器中使用新的催化剂,促使平衡2CO+2NO?2CO2+N2向正反应方向移动,减少污染物的排放 |
19.下列关于接触法制硫酸的叙述,不正确的是( )
| A. | 黄铁矿的主要成分是FeS | B. | SO3与水反应是放热反应 | ||
| C. | 用98.3%的硫酸吸收SO3 | D. | 热交换的目的是充分利用反应热 |
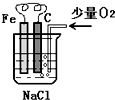 分析图,按要求写出有关反应方程式:
分析图,按要求写出有关反应方程式: