题目内容
12.将29.6g碳酸钠和碳酸氢钠的混合物加热到质量不再减少为止,冷却,称得固体质量为26.5g.问:(1)原固体混合物中碳酸氢钠的质量是多少?
(2)把原固体混合物与足量盐酸完全反应生成的CO2在标准状况下的体积是多少?
分析 (1)加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,根据固体质量差,利用差量法计算碳酸氢钠的质量;
(2)再计算混合物中Na2CO3的质量,根据碳原子守恒计算生成二氧化碳的体积.
解答 解:(1)已知M(NaHCO3 )=84.0g/mol
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ 固体质量减少△m
2 mol×84.0g/mol 62.0 g
m(NaHCO3 ) (29.6-26.5)g
所以2 mol×84.0g/mol:62.0 g=m(NaHCO3 ):(29.6-26.5)g
解得m(NaHCO3 )=8.40g,
答:原固体混合物中碳酸氢钠的质量是8.40g.
(2)原混合物中m(Na2CO3)=(29.6-8.40)g=21.2g
则n(Na2CO3)=2.12g÷106 g/mol=0.200 mol
n=(NaHCO3 )=8.40g÷84 g/mol=0.100mol,
由碳原子守恒可知V(CO2)=(0.200+0.100)mol×22.4L/mol=6.72L,
答:生成的CO2在标准状况下的体积是6.72L.
点评 本题考查混合物的计算,明确发生反应的实质为解答关键,注意利用差量法计算,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
2.铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.下列有关铅酸蓄电池的说法正确的是( )
| A. | 充放电时,溶液的导电能力变化不大 | |
| B. | 电解稀硫酸可能发生的反应是:Cu+H2SO4 $\frac{\underline{\;电解\;}}{\;}$ CuSO4+H2↑ | |
| C. | 充电时,铅酸蓄电池的阴极与外接电源的正极相连 | |
| D. | 充电时的阳极反应式为:Pb+4OH-+2e-═PbO2+2H2O |
7.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,2克氢气所含原子数目为NA | |
| B. | 在标准状况下,O2和H2混合气体1mol所占的体积约为22.4 L | |
| C. | 在常温常压下,22.4LH2O所含的原子数目为3NA | |
| D. | 4.6克钠与水反应时失去的电子数目为0.1NA |
17.以下有关物质结构的描述正确的是( )
| A. | 二氯甲烷分子为正四面体结构 | |
| B. | 2-丁烯分子中4个碳原子不在同一平面内 | |
| C. | 甲苯分子中7个碳原子都在同一平面内 | |
| D. | 丙烷分子中的3个碳原子一定在同一条直线上 |
4.下列物质属于纯净物的是( )
| A. | 水玻璃 | B. | 漂白粉 | C. | 液氨 | D. | 24K黄金 |
1.下列说法中正确的是( )
| A. | 金属铜在物质分类中属于单质,所以它既不是电解质也不是非电解质 | |
| B. | 强电解质水溶液的导电性一定比弱电解质水溶液的导电性强 | |
| C. | 用硫化亚铁除去污水中的铜离子,是利用硫化亚铁比硫化铜在水中更难溶 | |
| D. | 对于已经达到平衡的化学反应,改变压强,平衡常数(K)可能改变 |
2.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 在某密闭容器中加入0.5 molN2和1.5 mol H2,充分反应后容器中物质含有的N-H键数为3NA | |
| B. | 标准状况下,2.24 L SO3含有的原子数为0.4 NA | |
| C. | 71 g氯气与足量铁反应过程中转移的电子数为2NA | |
| D. | 电解饱和食盐水时,当阴极产生22.4 L H2时,电路中转移的电子数为2NA |

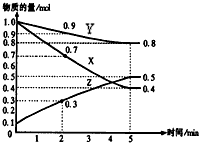 在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.
在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.