题目内容
2.NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 在某密闭容器中加入0.5 molN2和1.5 mol H2,充分反应后容器中物质含有的N-H键数为3NA | |
| B. | 标准状况下,2.24 L SO3含有的原子数为0.4 NA | |
| C. | 71 g氯气与足量铁反应过程中转移的电子数为2NA | |
| D. | 电解饱和食盐水时,当阴极产生22.4 L H2时,电路中转移的电子数为2NA |
分析 A.N2和H2的反应是可逆反应;
B.标况下,SO3是固体;
C.求出氯气的物质的量,然后根据反应后氯元素的价态为-1价来分析;
D.氢气所处的状态不明确.
解答 解:A.N2和H2的反应是可逆反应,不能进行彻底,故生成的氨气的物质的量小于1mol,故N-H键数小于3NA个,故A错误;
B.标况下,SO3是固体,无法计算物质的量,故B错误;
C.71g氯气的物质的量为1mol,而反应后氯元素的价态为-1价,故1mol氯气得2mol电子,故C正确;
D.氢气所处的状态不明确,不一定是标况,即物质的量不一定是1mol,故D错误.
故选C.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
13.乙醇蒸气和乙烯的混合气体aL完全燃烧,消耗相同状况下bL氧气,则( )
| A. | b=2a | B. | V(乙烯)=0.5aL | C. | n(H2O)=n(CO2) | D. | b=3a |
17.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是( )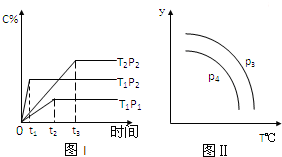

| A. | 若P3>P4,则y轴表示B的百分含量 | |
| B. | 若P3>P4,则y轴表示混合气体的平均摩尔质量 | |
| C. | 若P3<P4,则y轴表示B的体积分数 | |
| D. | 若P3<P4,则y轴表示混合气体的密度 |
7.将铜和氧化铁的混和物溶于足量稀盐酸中,向所得溶液中滴入2滴KSCN溶液后出现红色.下列有关说法错误的是( )
| A. | 容器中可能有固体残渣 | B. | 所得溶液中一定存在Fe2+ | ||
| C. | 反应过程中水的电离程度增大 | D. | 再加入铜后,溶液红色逐渐退去 |
10.以下实验操作正确的是( )
| A. | 用燃着的酒精灯去点燃另一个酒精灯 | |
| B. | 用托盘天平称量氢氧化钠固体时,托盘里应该垫上纸进行称量 | |
| C. | 蒸发某溶液,待溶液中有大量晶体析出时即停止加热 | |
| D. | 浓硫酸稀释时,沿着烧杯壁将水慢慢加如到浓硫酸中,边加边搅拌 |
11.NaOH固体溶于水,放出大量的热量是因为( )
| A. | 只发生水合过程 | B. | 只发生化学过程 | ||
| C. | 水合过程放热大于扩散过程吸热 | D. | 扩散过程吸热大于水合过程放热 |
 二氧化氯是一种黄绿色到橙黄色的气体,是国际上公认为安全、无毒的绿色消毒剂.回答下列问题:
二氧化氯是一种黄绿色到橙黄色的气体,是国际上公认为安全、无毒的绿色消毒剂.回答下列问题: .二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠和另一种氯的含氧酸盐,同时生成水,该反应的离子方程式为2ClO2+2OH-=ClO2-+ClO3-+H2O.
.二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠和另一种氯的含氧酸盐,同时生成水,该反应的离子方程式为2ClO2+2OH-=ClO2-+ClO3-+H2O.