题目内容
5.元素及其化合物的知识是化学的重点内容,下列叙述中不正确的是( )| A. | 漂白液中的有效成分是Ca(ClO)2 | |
| B. | 钠呈银白色、质软、熔点相对较低、密度比水小 | |
| C. | 高温下用焦炭还原SiO2制取粗硅 | |
| D. | 二氧化硅是一种熔沸点很高、硬度很大、不溶于水的酸性氧化物 |
分析 A.氯气与NaOH溶液反应制备漂白液;
B.金属钠物理性质:银白色金属、质软、熔点低、密度比水小;
C.工业上用焦炭还原二氧化硅制备粗硅;
D.二氧化硅不溶于水,是原子晶体,和碱反应生成盐和水.
解答 解:A.氯气与NaOH溶液反应制备漂白液,漂白液中含NaCl、NaClO,NaClO具有强氧化性,可漂白有色物质,则漂白液的有效成分是NaClO,故A错误;
B.钠呈银白色、质软、熔点相对较低、密度比水小,故B正确;
C.高温下用焦炭还原SiO2制取粗硅,SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO,故C正确;
D.二氧化硅是一种原子晶体,熔沸点很高、硬度很大、不溶于水,和碱溶液反应生成盐和水,属于酸性氧化物,故D正确;
故选A.
点评 本题考查了物质性质、物质制备、物质组成的分析判断,注意知识积累,题目难度中等.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
15.下列各组物质中,其分子数相同的是( )
| A. | 1 g H2和8 g O2 | |
| B. | 1 mol CO和22.4 L CO2 | |
| C. | 标准状况下,1.12 L N2和2.24 L He | |
| D. | 常温常压下,16 g O2和0.5 mol N2 |
13.0.2mol•dm-3甲酸溶液中有3.2%的甲酸电离,它的电离常数是( )
| A. | 9.6×10-3 | B. | 4.8×10-5 | C. | 1.25×10-6 | D. | 2.0×10-4 |
20.下列实验方案设计正确的是( )
| A. | 分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 | |
| B. | 将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 | |
| C. | 失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可以用碳酸铵溶液鉴别 | |
| D. | 检验从火星上带回来的红色物体是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
10.下列测定实验能证明甲酸是弱电解质的是( )
| A. | 测恰好中和等体积、等物质的量浓度的甲酸和硫酸消耗NaOH的量 | |
| B. | 测甲酸和硫酸的水溶性 | |
| C. | 测相同体积不同物质的量浓度的甲酸钠和硫酸钠溶液的pH值 | |
| D. | 测相同物质的量浓度的甲酸和硫酸溶液的导电性 |
17.某温度时,Ag2SO4在水中的沉淀溶解曲线如图所示.该温度下,下列说法正确的是( )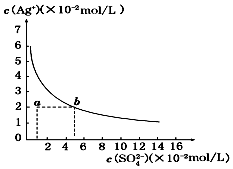

| A. | 含有大量SO42-的溶液中肯定不存在Ag+ | |
| B. | 0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合不会生成沉淀 | |
| C. | Ag2SO4的溶度积常数(Ksp)为1×10-3 | |
| D. | a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
14.下列离子组中,在相应的环境中能大量共存的是( )
| 选项 | 环境要求 | 离子组 |
| A | Fe2(SO4)3溶液中 | K+、AlO2-、Cl-、NO3- |
| B | 与Al反应能放出H2的溶液中 | Fe2+、Na+、NO3-、SO42- |
| C | 水电离产生的c(H+)=10-12mol/L的溶液 | ClO-、CO32-、NH4+、NO3-、SO32- |
| D | 向溶液中逐滴滴加烧碱溶液先有沉淀产生,后沉淀消失 | Na+、Al3+、Cl-、SO42- |
| A. | A | B. | B | C. | C | D. | D |
10.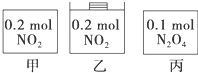 甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )
甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )
 甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )
甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的( )| A. | 平衡时各容器内n(NO2)的大小顺序为乙>甲>丙 | |
| B. | 平衡时NO2的百分含量:乙>甲=丙 | |
| C. | 平衡时甲中NO2与丙中N2O4的转化率一定相同 | |
| D. | 平衡时混合物的平均相对分子质量:乙>甲=丙 |