题目内容
下列说法不正确的是( )
| A、向纯水中加入盐酸使水的电离平衡逆向移动,水的离子积减小 |
| B、反应NH3(g)+HCl(g)═NH4Cl(s)△H<0,低于一定温度自发,高于一定温度非自发 |
| C、铅蓄电池在放电过程中,负极质量减少,正极质量增加 |
| D、用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
考点:原电池和电解池的工作原理,焓变和熵变,水的电离,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:A、温度不变,水的离子积不会变化;
B、根据△G=△H-T?△S<0时,反应能自发进行判断;
C、根据铅蓄电池的工作原理来回答;
D、硫酸钡的溶解度大于碳酸钡,可以实现硫酸钡到碳酸钡的沉淀转化.
B、根据△G=△H-T?△S<0时,反应能自发进行判断;
C、根据铅蓄电池的工作原理来回答;
D、硫酸钡的溶解度大于碳酸钡,可以实现硫酸钡到碳酸钡的沉淀转化.
解答:
解:A、向纯水中加入盐酸,溶液中氢离子浓度增大,水的电离向着逆向移动;由于温度不变,水的离子积不变,故A错误;
B、根据反应得出,△H<0,△S<0,则△G=△H-T?△S<0自发,所以低于一定温度自发,高于一定温度非自发,故B正确;
C、铅蓄电池工作时,负极是金属铅失电子,正极上是二氧化铅得电子,都是生成硫酸铅,质量增加,故C错误;
D、用饱和Na2CO3溶液处理BaSO4沉淀,用于碳酸钡溶度积小于硫酸钡,可将BaSO4转化为BaCO3,故D正确;
故选AC.
B、根据反应得出,△H<0,△S<0,则△G=△H-T?△S<0自发,所以低于一定温度自发,高于一定温度非自发,故B正确;
C、铅蓄电池工作时,负极是金属铅失电子,正极上是二氧化铅得电子,都是生成硫酸铅,质量增加,故C错误;
D、用饱和Na2CO3溶液处理BaSO4沉淀,用于碳酸钡溶度积小于硫酸钡,可将BaSO4转化为BaCO3,故D正确;
故选AC.
点评:本题考查了水的电离、水的离子积、反应热与焓变、铅蓄电池工作原理、沉淀转化平衡等知识,题目难度中等,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况.

练习册系列答案
相关题目
下列物质既能与盐酸又能与氢氧化钠反应的是( )
①Al2O3 ②Al(OH)3 ③NaHCO3 ④Fe ⑤CaCO3 ⑥SiO2.
①Al2O3 ②Al(OH)3 ③NaHCO3 ④Fe ⑤CaCO3 ⑥SiO2.
| A、①②③ | B、①②⑥ |
| C、④⑤⑥ | D、②③⑤ |
某芳香族化合物A的分子式为C8H10O,它的结构中有两个甲基(-CH3),且它遇FeCl3溶液可发生显色反应,这样的结构共有( )
| A、4种 | B、5种 | C、6种 | D、7种 |
已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )
| A、KClO3是氧化剂 |
| B、1mol KClO3参加反应时有10mol电子转移 |
| C、该反应中的H2SO4只体现酸,不体现氧化性 |
| D、发生氧化反应与还原反应的氯元素的质量比为5:1 |
在下述反应中,浓H2SO4既表出现氧化性,又表现出酸性的是( )
| A、C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O |
| B、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O |
| C、Na2CO3+H2SO4=Na2SO4+CO2↑+H2O |
| D、Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O |
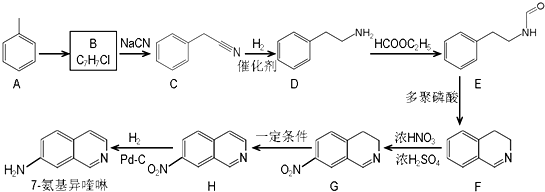
 .请回答下列问题:
.请回答下列问题: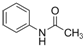 ),请设计合成路线(无机试剂及溶剂任选).
),请设计合成路线(无机试剂及溶剂任选). 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g)
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g) 某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):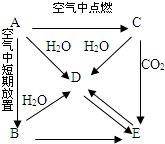 有A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按下图所示的关系相互转化,已知A为单质.按要求回答问题.
有A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按下图所示的关系相互转化,已知A为单质.按要求回答问题.